题目内容
二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
①CO(g)+2H2(g)![]() CH3OH(g);ΔH1=90.7 kJ·mol-1
CH3OH(g);ΔH1=90.7 kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g);ΔH2=23.5 kJ·mol-1
CH3OCH3(g)+H2O(g);ΔH2=23.5 kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH3=41.2 kJ·mol-1
CO2(g)+H2(g);ΔH3=41.2 kJ·mol-1
(1)–步法合成二甲醚的总反应可表示为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),该反应的AH=________.平衡常数表达式为________.
CH3OCH3(g)+CO2(g),该反应的AH=________.平衡常数表达式为________.
(2)另一种合成二甲醚的方法称为“二步法”,该工艺为让反应①和反应②分别在不同的反应器中进行,无反应③发生,而“一步法”的反应③的发生提高了CH3OCH3的产率,原因是________.
(3)由CO2加氢直接合成二甲醚可以消除过度CO2排放对环境的影响.当在合成反应器中加入碳氢比[n(CO2)/n(H2)]为1∶3的混合气体,在二定条件下反应得到二甲醚和水蒸气,实现了CO2的减排目的.该反应的反应方程式为________;判断该反应在一定温度下,体积恒定的密闭容器中下列不能作为达到化学平衡状态的依据是________
A.容器的密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚
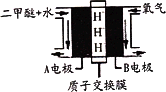
(4)以二甲醚为燃料的燃料电池工作原理如图所示:则正极为________(填A极或B极),写出A电极反应式________
答案:

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目

 CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 与H2合成二甲醚的化学方程式为 .
与H2合成二甲醚的化学方程式为 . CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。