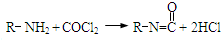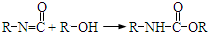题目内容
下列分子的结构中,原子的最外层电子不能都满足8电子稳定结构的是( )
| A、HF3 |
| B、CCl4 |
| C、CO2 |
| D、PCl5 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:根据原子最外层电子数和化合价判断,在化合物中,原子最外层电子数等于原子的价层电子数+|化合价|,以此进行分析.
解答:
解:A.NF3中N原子的最外层电子为5+3=8,F的最外层电子为:7+|-1|=8,都满足8电子稳定结构,故A不选;
B.CCl4中,C原子的最外层电子为:4+4=8,Cl原子的最外层电子为:7+|-1|=8,都满足8电子稳定结构,故B不选;
C.CO2中,C原子的最外层电子为:4+4=8,O原子的最外层电子为:6+|-2|=8,都满足8电子稳定结构,故C不选;
D.PCl5中,P原子的最外层电子为:5+5=10,不都满足8电子稳定结构,故D选.
故选D.
B.CCl4中,C原子的最外层电子为:4+4=8,Cl原子的最外层电子为:7+|-1|=8,都满足8电子稳定结构,故B不选;
C.CO2中,C原子的最外层电子为:4+4=8,O原子的最外层电子为:6+|-2|=8,都满足8电子稳定结构,故C不选;
D.PCl5中,P原子的最外层电子为:5+5=10,不都满足8电子稳定结构,故D选.
故选D.
点评:本题考查了8电子稳定结构的判断,明确元素的族序数、成键数及最外层电子数即可解答,注意二氧化碳分子中,碳原子和每个氧原子形成两个共用电子对,为易错点.

练习册系列答案
相关题目
下列对电负性的理解不正确的是( )
| A、电负性是人为规定的一个相对数值,不是绝对标准 |
| B、元素电负性的大小反映了元素对键合电子引力的大小 |
| C、元素的电负性越大,则元素的非金属性越强 |
| D、元素的电负性是元素固有的性质,与原子结构无关 |
X元素的价电子结构为ndn+2(n+1)sn-2,则下列判断正确的是( )
| A、X元素的电子排布式为:1S22S22P63S23P63d104s24p64d65s2 |
| B、X元素位于第五周期 |
| C、X元素位于VIB族 |
| D、X元素原子最外层有2个电子 |

 硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在.
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在.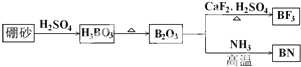
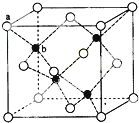
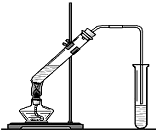 (1)装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
(1)装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止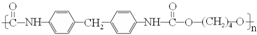 ),合成路线如图所示(部分反应试剂及生成物、条件省略).
),合成路线如图所示(部分反应试剂及生成物、条件省略).