题目内容
一种Na2O和Na2O2的混合物,当吸收17.6gCO2,充分反应后放出3.2gO2,求混合物中Na2O和Na2O2各为多少g?
考点:化学方程式的有关计算,钠的重要化合物
专题:计算题
分析:根据反应:2Na2O2+2CO2=Na2CO3+O2,计算过氧化钠的质量、该反应消耗二氧化碳的质量,进而计算氧化钠反应消耗二氧化碳的质量,再根据反应:Na2O+CO2=Na2CO3,计算氧化钠的质量.
解答:
解:充分反应后放出3.2gO2,则:
2 Na2O2+2 CO2=Na2CO3+O2
156g 88g 32g
m n 3.2g
故m=
=15.6g n=
=8.8g
故与氧化钠反应的二氧化碳的质量为17.6g-8.8g=8.8g
Na2O+CO2=Na2CO3
62g 44g
x 8.8g
所以x=
=12.4g,
答:混合物中过氧化钠为15.6g,氧化钠质量为12.4g.
2 Na2O2+2 CO2=Na2CO3+O2
156g 88g 32g
m n 3.2g
故m=
| 156g×3.2g |
| 32g |
| 88g×3.2g |
| 32g |
故与氧化钠反应的二氧化碳的质量为17.6g-8.8g=8.8g
Na2O+CO2=Na2CO3
62g 44g
x 8.8g
所以x=
| 62g×8.8g |
| 44g |
答:混合物中过氧化钠为15.6g,氧化钠质量为12.4g.
点评:本题考查混合物计算、化学方程式计算,比较基础,侧重考查学生分析计算能力.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
能用勒夏特列原理解释的是( )
| A、红棕色的NO2,加压后颜色先变深后变浅 |
| B、工业上合成NH3反应使用催化剂 |
| C、实验室可以采用排饱和食盐水收集Cl2 |
| D、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
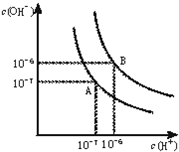 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.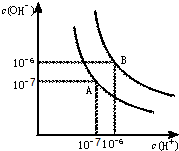 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.