题目内容
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1.请回答下列问题:
(1)用太阳能分解10 mol水消耗的能量是________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________;
(3)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);

下列说法正确的是________(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=nA/tAmol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时增大![]()
(4)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为________;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________.理想状态下,该燃料电池消耗1 mol甲醇所能产生的最大电能为702.1 KJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
解析:
|
(1)2858 (2)CH3OH(l)+O2(g) (3)③④ (4)1-a/2 (5)CH3OH(g)+H2O-6e-=CO2+6H+ 3/2O2++6H++6e-=3H2O 96.6% |

 (2011?江西)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
(2011?江西)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题: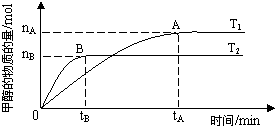 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1. 碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.