题目内容
a克镁铝合金放在b克的干锅内加热(镁只生成MgO),充分反应后总重量为c克,求铝的质量分数.
考点:有关混合物反应的计算
专题:
分析:镁铝合金加热后生成氧化铝和氧化镁,设出镁和铝的物质的量,反应后增重的质量为氧元素质量,分别根据金属质量、电子守恒列式计算出铝的物质的量,再计算出合金中铝的质量分数.
解答:
解:设Al物质的量为x,Mg物质的量为y,
根据金属的质量可得:①27x+24y=a,
反应后金属增重的质量为:(c-a-b)g,镁铝合金加热生成氧化铝、氧化镁,所以金属增重的质量为O元素的质量,根据电子守恒可得:②3x+2y=
×2,
联立①②解得:x=
mol,
合金中铝的质量分数为:
=
,
答:合金中铝的质量分数为
.
根据金属的质量可得:①27x+24y=a,
反应后金属增重的质量为:(c-a-b)g,镁铝合金加热生成氧化铝、氧化镁,所以金属增重的质量为O元素的质量,根据电子守恒可得:②3x+2y=
| (c-a-b) |
| 16 |
联立①②解得:x=
| 3c-5a-3b |
| 18 |
合金中铝的质量分数为:
| ||
| ag |
| 3(3c-5a-3b) |
| 2a |
答:合金中铝的质量分数为
| 3(3c-5a-3b) |
| 2a |
点评:本题考查了混合物反应的计算,题目难度中等,明确合金加热后增重质量成分为解答关键,注意质量守恒、电子守恒在化学计算中的应用方法,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列说法正确的是( )
| A、酸性氧化物一定是非金属氧化物,金属氧化物一定是碱性氧化物 |
| B、氢气中氢元素的化合价为0,所以氢分子中没有化学键 |
| C、离子键只存在于离子化合物中,而共价键可能存在于离子化合物或共价化合物中 |
| D、往饱和NaCl溶液中先通CO2至饱和,再往溶液中通NH3至饱和,可析出大量NaHCO3固体 |
燃烧等质量的下列烃,生成CO2最多的是( )
| A、CH4 |
| B、C6H6 |
| C、C2H6 |
| D、C3H6 |
下列有关化学用语表示正确的是( )
| A、中子数为8的N原子:78N |
B、离子结构示意图: 只能表示35Cl- 只能表示35Cl- |
| C、碳酸氢钠在水溶液中的电离方程式:NaHCO3=Na++HCO3- |
| D、作为相对原子质量标准的碳原子:614C |
临界状态指的是物质的气态和液态平衡共存时的一个边缘状态,在这种状态下,液体密度和饱和的蒸汽密度相同,因而他们的界面小时,这种状态只能在临界温度和临界压强下实现,可用临界点表示.二氧化硫的临界点为 157℃和78 atm,液态二氧化硫在25℃时的蒸汽压强为3.8 atm.试判断下列说法正确是( )
| A、二氧化硫的正常沸点在 25~157℃之间 |
| B、25℃贮有半满液态二氧化硫容器内的压力为5 atm |
| C、气态二氧化硫在150℃,80 atm时不能液化 |
| D、25℃和1 atm下二氧化硫是气体 |
下列装置或操作能达到实验目的是( )
A、 中和热测定 |
B、 构成原电池 |
C、 收集氢气 |
D、 定容 |
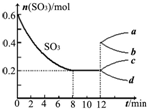 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
 (R为烷基,X为卤素原子)②RCH2CH2OH
(R为烷基,X为卤素原子)②RCH2CH2OH