题目内容
16.海水占地球总蓄水量的97.2%,若把海水的淡化和化工生产结合起来,就可充分利用海洋资源来解决淡水资源缺乏的问题.(1)氯化钠中的金属元素在周期表中的位置是第三周期 IA族;
(2)目前常用的“海水淡化”主要技术之一是蒸馏法,蒸馏法属于物理变化(填“物理变化”或“化学变化”).
分析 (1)原子电子层数等于周期序数;最外层电子式等于主族序数;
(2)有新物质生成的变化为化学变化,没有新物质生成的变化为物理变化.
解答 解:(1)钠原子最外层有1个电子,有3个电子层,所以其在周期表中位置:第三周期 IA族;
故答案为:第三周期 IA族;
(2)蒸馏法是利用物质沸点不同分离物质的方法,过程中没有新物质生成,属于物理变化;
故答案为:物理变化.
点评 本题考查了原子结构及元素周期表关系、化学变化与物理变化的判断,明确是否有新物质生成是解题关键,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
6.天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式分别为:
CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O C3H8+5O2$\stackrel{点燃}{→}$3CO2+4H2O
现有一套以天然气为燃料的灶具,今改烧液化石油气,应采取的正确措施是( )
CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O C3H8+5O2$\stackrel{点燃}{→}$3CO2+4H2O
现有一套以天然气为燃料的灶具,今改烧液化石油气,应采取的正确措施是( )
| A. | 减小空气进入量,增大石油气进入量 | |
| B. | 两种气体量都减少 | |
| C. | 增大空气进入量,也增大石油气进入量 | |
| D. | 增大空气进入量,或减少石油气进入量 |
7.软锰矿的主要成分为MnO2,含少量Al2O3和SiO2.闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质.现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如图(中间产物的固体部分已经略去).

已知:
Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在.
Ⅱ.各种金属离子完全沉淀的pH如表:
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是将矿石粉碎、加热、搅拌等(任写一种).①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式3MnO2+2FeS+6H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$3MnSO4+Fe2(SO4)3+2S+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是Cu、Cd.
(3)步骤③中MnO2的其作用是将Fe2+氧化为Fe3+,另外一种物质X可以是AC.
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为:Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式Li1-xMnO2+xLi++xe-=LiMnO2.
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为CN-+H2S=HCN+HS-.在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020mol•L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4 mol•L-1时,Mn2+开始沉淀,则a=5.[已知:Ksp(MnS)=1.4×10-15].

已知:
Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在.
Ⅱ.各种金属离子完全沉淀的pH如表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是将矿石粉碎、加热、搅拌等(任写一种).①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式3MnO2+2FeS+6H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$3MnSO4+Fe2(SO4)3+2S+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是Cu、Cd.
(3)步骤③中MnO2的其作用是将Fe2+氧化为Fe3+,另外一种物质X可以是AC.
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为:Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式Li1-xMnO2+xLi++xe-=LiMnO2.
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为CN-+H2S=HCN+HS-.在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020mol•L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4 mol•L-1时,Mn2+开始沉淀,则a=5.[已知:Ksp(MnS)=1.4×10-15].
4.在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A. | Cl-、Na+、NO3-、Ca2+ | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | K+、Fe2+、Cl-、NO3- | D. | Cu2+、NH4+、I-、Cl- |
8.某气体的摩尔质量为M,分子质量为m.若1摩尔该气体的体积为Vm,密度为ρ,则该气体单位体积分子数为(阿伏伽德罗常数为NA)( )
| A. | $\frac{{N}_{A}}{{V}_{m}}$ | B. | $\frac{M}{m{V}_{m}}$ | C. | $\frac{ρ{N}_{A}}{M}$ | D. | $\frac{ρ{N}_{A}}{m}$ |
 (2)S原子结构示意图
(2)S原子结构示意图
 (4)Cl-离子的结构示意图
(4)Cl-离子的结构示意图 .
.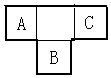 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.且含B元素物质的大量燃烧是形成酸雨的主要原因之一.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.且含B元素物质的大量燃烧是形成酸雨的主要原因之一.  .
.