题目内容
17.在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)?C(g)+D(g) 已达平衡标志的是( )| A. | 混合气体的密度 | B. | B物质的相对分子质量 | ||
| C. | 混合气体的压强 | D. | 气体的总物质的量 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、混合气体的密度不变,说明气体的质量不变,正逆反应速率相等,反应达平衡状态,故A正确;
B、B是纯净物,相对分子质量是定值,一直不变,故B错误;
C、两边气体的计量数相等,所以容器的压强始终不变,所以不能作为平衡状态的标志,故C错误;
D、两边气体的计量数相等,气体的总物质的量一直不变,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
7.100mL6.0mol•L-1H2SO4与过量的锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 硫酸铵固体 | B. | 硫酸钾溶液 | C. | NaHSO4固体 | D. | Na2CO3固体 |
8.下列叙述中,正确的是( )
| A. | 氧化还原反应的本质是元素化合价发生了变化 | |
| B. | 含化合价升高元素的反应物被氧化 | |
| C. | 得到电子的物质被氧化 | |
| D. | 氧化还原反应中,氧化剂和还原剂一定是两种物质 |
12.要使在容积恒定的密闭容器中进行的可逆反应2A(气)+B(固)═2C(气),△H<0的正反应速率显著加快,可采用的措施是(不考虑固、气态间的接触面积)( )
| A. | 降温 | B. | 加入B | ||
| C. | 增大体积使压强减小 | D. | 加入A |
9.用于电动汽车的铝-空气燃料电池通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.则下列说法正确的是( )
| A. | 以NaOH溶液为电解液时,负极反应为Al+3OH--3e-═Al(OH)3↓ | |
| B. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-═4OH- | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 | |
| D. | 电池工作时,电子通过外电路从正极流向负极 |
6.下列化合物的同分异构体数目为7种的是(不考虑立体异构)( )
| A. | 丁醇 | B. | 丁烯 | C. | 一氯戊烷 | D. | 己烷 |
7.在下列物质中,所含化学键类型相同的一组是( )
| A. | CCl4、CH4 | B. | NH4Cl、HCl | C. | NaOH、H2O | D. | Na2S、SO2 |


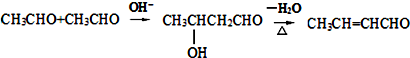
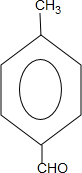 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +nH2O.
+nH2O.
 .
.