(8分)碱石灰是实验室中常用的干燥剂。
[资料]
①碱石灰是氧化钙、氢氧化钠的固体混合物,易吸收空气中二氧化碳和水蒸气。
②氯化钙溶液呈中性。
[提出问题]
对实验室中久置的碱石灰样品的成分进行探究。
[进行猜想]
久置碱石灰样品中可能含有CaO、NaOH、Ca(OH)2、Na2CO3、CaCO3中的两种或两种以上成分。上述五种物质中,属于碱的是_____________________。
样品中可能含有Ca(OH)2、Na2CO3的原因是(请用化学方程式表示)_________、_______ 。
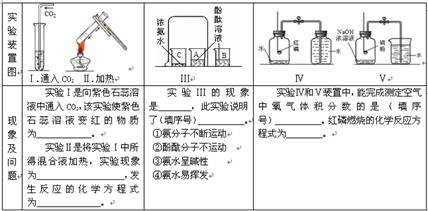
[实验过程] 
试回答下列问题:
(1)操作①的名称是_________。
(2)根据实验操作及现象,下列说法正确的是__________。
| A.样品中加水后容器壁发热,说明样品中一定含有CaO |
| B.样品加足量水后仍有固体,说明样品中一定含有CaCO3 |
| C.溶液A加入CaCl2溶液后产生固体,说明样品中一定含有Na2CO3 |
| D.溶液C加入酚酞变红,说明样品中一定含有NaOH |
(4)写出溶液C中所含阴离子的符号____________________。
[实验结论]
该久置碱石灰样品中肯定含有的成分是(填化学式) ,其它成分尚不能确定。
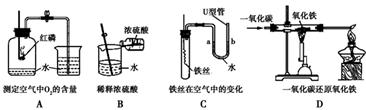
(6分)下列A ~ D是初中化学中的四个实验,请按要求填空:
| A.CO2灭火 | B.水电解 | C.探究燃烧条件 | D.空气中氧气含量的测定 |
(2)写出实验B发生反应的化学方程式 ;由此实验得出水是由氢元素和 元素组成的。
(3)实验C中盛放白磷和红磷用的是铜片,这是利用铜片的 ;由此实验证明可燃物燃烧所需的条件是 。
(4)实验D中燃烧匙中所盛药品为红磷,实验中红磷要过量,其原因是 。
(7分)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%。老师说,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种。
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙溶液,理由是 。
(2)小亮取少量样品于试管中,滴加 试液,试液变红色,该溶液不可能是 。
(3)为了进一步确定该溶液的成分,小亮设计了以下实验方案:
方案A:选择稀盐酸来确定该溶液的成分;
方案B:选择无色酚酞试液来确定该溶液的成分;
你认为以上方案中合理的是 ,若选择一种常见的碱溶液来确定,有关反应
的化学方程式为 。
(4)小亮通过上述方法证明该溶液的成分为NaOH,于是他取一定体积的NaOH溶液
(20℃),并向其中滴加10%的盐酸(20℃),测得反应中溶液的温度与加入盐酸体积的变化如下。
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度 (t)/℃ | 25.2 | 29.6 | 32.0 | 36.0 | 38.2 | 36.7 | 35.7 | 34.7 | 33.7 | 32.9 |
①加入盐酸的量在2~10 mL之间时 。
②加入盐酸的量在10~20 mL之间时 。
(7分)同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了。为此某化学小组的同学进行了如下探究。
【提出猜想】甲:可能是酚酞溶液变质的缘故
乙:可能是氢氧化钠溶液与空气中二氧化碳反应的缘故
丙:可能是氢氧化钠与酚酞混合后与空气中氧气反应,使红色消失的缘故
丁:可能与氢氧化钠溶液的质量分数有关
【查阅资料】酚酞是一种常用酸碱指示剂,遇碱性溶液变红。
【讨论分析】
(1)甲同学提出猜想后,很快被小组同学否定了,其理由是 。
(2)经过思考,大家认为乙同学的猜想也不正确,其理由是 。
【实验设计】
(3)为验证丙同学的猜想是否正确,小组同学做了如下实验,请完成表中内容。
| 实验步骤 | 实验目的 | 现象结论 |
| ①用煮沸过的蒸馏水配制某氢氧化钠溶液。 | 。 | 溶液先变成红色,一会儿红色又消失。 丙同学的猜想不正确。 |
| ②取少量上述氢氧化钠溶液,滴入酚酞,然后在上方滴一些植物油。 | 。 |
| 实验方法 | 观察到的现象和结论 |
| 方案一:分别配制不同质量分数的氢氧化钠溶液,然后各取少量并滴加2滴酚酞溶液。 | 质量分数小的溶液中红色不消失,质量分数大的溶液中红色会消失,则证明 。 |
| 方案二: 。 | 出现红色且不褪去,结论同上。 |
⑸若将质量分数为10%和20%的氢氧化钠溶液等质量混合,所得溶液中溶质的质量分数是 。
A.10% B.15% C.20% D.30%