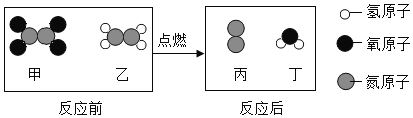
【题目】黄铜(铜和锌的合金)外观与黄金十分相似,但黄铜在潮湿的空气中长时间放置会产生铜绿,而黄金就不会。某化学兴趣小组的同学,对一件生满了铜绿的制品展开了探究活动。
[实验探究]①用小刀刮下铜绿,放入隔绝空气容器内加热,生成了黑色固体氧化铜、水和使澄清石灰水变浑浊的无气味气体。
②取一小块表面有铜绿的黄铜片放入稀硫酸中(如下图A),观察到有气泡产生,溶液变蓝。通过实验探究①可知铜绿的成分中由_____种元素组成。
[提出问题1 ]实验探究②中生成的气体是什么?
[猜想与假设]
假设一:生成的气体是CO2
假设二:生成的气体是H2
假设三:生成的气体是_______
[实验验证]
同学们又连接了如下图所示的装置进行验证:
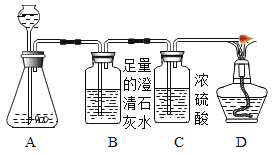
A中反应较长时间后,再点燃D处的酒精灯。观察到________现象,则证明假设三成立。若在A的样品中加入稀硫酸后,立即点燃D处的酒精灯,可能造成的结果是________。
[提出问题2] A中反应后溶液呈蓝色,其中溶质有哪些?
某同学认为蓝色溶液中可能含有CuSO4和H2SO4。
[实验验证]为证明蓝色溶液中可能存在CuSO4和H2SO4,同学们进行了如下实验。
实验操作 | 实验现象 | 实验结论 |
取少量蓝色溶液于试管中,加入过量打磨过的锌片 | ____ | 溶质中一定含有H2SO4 |
_____ | 溶质中一定含有CuSO4 |
你认为上述反应后溶液中还存在的金属离子是_______(写离子符号)。
[拓展提升]
有不法分子用黄铜冒充黄金行骗,请你再设计另外两种方法,辨别真假黄金。
序号 | 方法 | 现象 | 结论 |
1 | _____ | _____ | 为假黄金 |
2 | _____ | _____ |
【题目】在做“金属与酸反应”实验时,同学们对影响“稀盐酸与金属反应的速率的因素”产生了兴趣。对此,同学们选择了打磨过且粗细长度相同的铁丝、锌丝与等体积的稀盐酸完全反应,设计子以下5组对比实验进行了探究。
[设计实验]
实验 | 所用金属 | 稀盐酸中溶质的质量分数/% | 温度/°C | 从反应开始到收集 10mL氢气所用的时间/s |
1 | 铁丝 | 5 | 20 | 450 |
2 | 铁丝 | 8 | 20 | 240 |
3 | 铁丝 | 10 | 20 | 115 |
4 | 铁丝 | 10 | 30 | 65 |
5 | 锌丝 | 10 | 30 | 43 |
[数据分析]通过上表数据可知稀盐酸与金属反应的速率和金属的种类、____、_____有关。
(1)锌与稀盐酸反应的化学方程式为_________。
(2)由实验1、2、3可得出的结论是____________。
[反思交流]
通过该实验还可知,铁与锌的金属活动性强弱程度是_____。请再写一种比较铁和锌活泼性的方法________。
【题目】下表是不同温度下硝酸钾的溶解度,下列有关说法正确的是
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
A.20°C时,100 g硝酸钾饱和溶液中含硝酸钾的质量是31.6g
B.接近饱和的硝酸钾溶液可通过升高温度的方法变为饱和溶液
C.60°C时,将60g硝酸钾固体在50g水中溶解,可得到110g的硝酸钾溶液
D.将80°C时硝酸钾饱和溶液降温至20°C,此时硝酸钾溶液溶质的质量分数约为24%
【题目】用如图装置进行铁与水蒸气在较高温度下反应的实验。取适量的铁粉与氢氧化钙平铺在试管底部,点燃酒精灯,待有较大气泡产生时,用燃着的木条靠近气泡直至有爆鸣声。

(提出问题)改变铁粉和氢氧化钙的质量及两者放置的方式是否会影响实验效果呢?
(查阅资料)①Ca(OH)2![]() CaO+H2O↑
CaO+H2O↑
②“气泡爆鸣时间”指从开始加热到第一个气泡爆鸣所用的时间
③“气泡爆鸣时间”越短,实验效果越好
(进行实验)按下表进行实验,记录“气泡爆鸣时间”。
表1
实验 | 铁粉与氢氧化钙的放置方式 | 铁粉的质量/g | 氢氧化钙的质量/g | 气泡爆鸣时间/s |
1 | 铁粉在上层 | 0.5 | 1.5 | 151 |
2 | 1.0 | 1.0 | 119 | |
3 | 1.5 | 0.5 | 66 | |
4 | 铁粉在下层 | 0.5 | 0.5 | 88 |
5 | 1.0 | a | 44 | |
6 | 1.5 | 1.0 | 54 | |
7 | 二者均匀混合 | 0.5 | 1.0 | 77 |
8 | 1.0 | 0.5 | 58 | |
9 | 1.5 | 1.5 | 60 |
(处理数据)根据表1,计算“气泡爆鸣时间”均值,结果如下:
表2
因素 | 放置方式 | 铁粉的质量/g | 氢氧化钙的质量/g | ||||||
铁粉 在上层 | 铁粉 在下层 | 均匀混合 | 0.5 | 1.0 | 1.5 | 0.5 | 1.0 | 1.5 | |
气泡爆鸣时间均值/s | 112 | 62 | 65 | 105 | 74 | 60 | 70 | 83 | 85 |
(解释与结论)
(1)实验中,使用氢氧化钙的目的是____。
(2)实验中,生成的气体为氢气,其理由是____。
(3)表1中,a为____g。
(4)根据表2推断,最佳的实验条件为___。
(反思与评价
(5)表2中,1.5 g铁粉对应的均值为60。计算该值依据的3个数据分别是______。
(6)实验中,铁粉在下层比上层的实验效果好。从金属性质的角度解释原因:______。
【题目】补全实验方案。请从A ~ C中任选二个作答,若均作答,按前二个计分。
序号 | 目的 | 操作 | 现象 | 结论 |
A | 验证温度对KNO3溶解度的影响 |
均加入_____KNO3固体 已知:20 ℃和40 ℃时,KNO3溶解度分别为31.6 g和63.9 g 装有红墨水 的毛细管 | 20℃时固体部分溶解,40℃时固体全部溶解 | KNO3的溶解度随温度的升高而增大 |
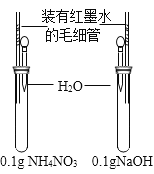
B | 研究NH4NO3和NaOH溶解时的温度变化 |
| __________ | NH4NO3溶解时温度降低;NaOH 溶解时温度升高 |
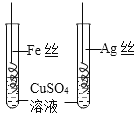
C | 比较Fe、Cu和Ag的金属活动性顺序 |
| Fe丝表面有红色固体析出,Ag丝表面无明显现象 | __________ |