题目内容
【题目】黄铜(铜和锌的合金)外观与黄金十分相似,但黄铜在潮湿的空气中长时间放置会产生铜绿,而黄金就不会。某化学兴趣小组的同学,对一件生满了铜绿的制品展开了探究活动。
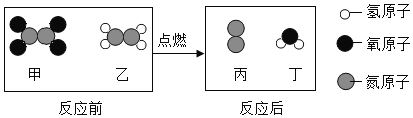
[实验探究]①用小刀刮下铜绿,放入隔绝空气容器内加热,生成了黑色固体氧化铜、水和使澄清石灰水变浑浊的无气味气体。
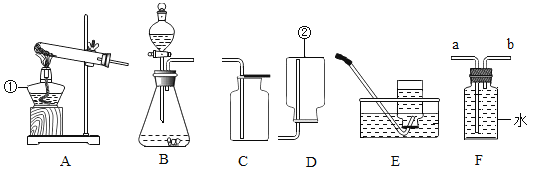
②取一小块表面有铜绿的黄铜片放入稀硫酸中(如下图A),观察到有气泡产生,溶液变蓝。通过实验探究①可知铜绿的成分中由_____种元素组成。
[提出问题1 ]实验探究②中生成的气体是什么?
[猜想与假设]
假设一:生成的气体是CO2
假设二:生成的气体是H2
假设三:生成的气体是_______
[实验验证]
同学们又连接了如下图所示的装置进行验证:
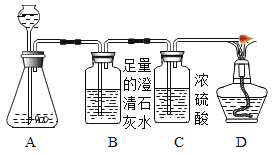
A中反应较长时间后,再点燃D处的酒精灯。观察到________现象,则证明假设三成立。若在A的样品中加入稀硫酸后,立即点燃D处的酒精灯,可能造成的结果是________。
[提出问题2] A中反应后溶液呈蓝色,其中溶质有哪些?
某同学认为蓝色溶液中可能含有CuSO4和H2SO4。
[实验验证]为证明蓝色溶液中可能存在CuSO4和H2SO4,同学们进行了如下实验。
实验操作 | 实验现象 | 实验结论 |
取少量蓝色溶液于试管中,加入过量打磨过的锌片 | ____ | 溶质中一定含有H2SO4 |
_____ | 溶质中一定含有CuSO4 |
你认为上述反应后溶液中还存在的金属离子是_______(写离子符号)。
[拓展提升]
有不法分子用黄铜冒充黄金行骗,请你再设计另外两种方法,辨别真假黄金。
序号 | 方法 | 现象 | 结论 |
1 | _____ | _____ | 为假黄金 |
2 | _____ | _____ |
【答案】四 CO2和H2 B中澄清石灰水变浑浊,D处气体燃烧产生淡蓝色火焰 发生爆炸 有气泡产生 有红色物质析出, 蓝色溶液逐渐变成无色 Zn2+ 取样,空气中灼烧 表面变黑并擦拭不掉 取样,放入硝酸银溶液中 溶液变蓝,样品表面有银白色固体物质生成
【解析】
[实验探究]
通过实验探究①,用小刀刮下铜绿,放入试管内加热,生成了黑色固体氧化铜、水和使澄清石灰水变浑浊的无气味气体,则该气体为二氧化碳,根据质量守恒定律,可知铜绿的成分中由铜、氢、氧、碳四种元素组成。
[猜想与假设]
可能是二氧化碳和氢气均有,故假设三:生成的气体是CO2和H2。
[实验验证]
A中反应较长时间后,再点燃D处的酒精灯,若观察到B中澄清石灰水变浑浊,D处气体燃烧产生淡蓝色火焰现象,说明生成气体中含有二氧化碳和氢气,则证明假设三成立,氢气不纯时点燃可能发生爆炸,若在A的样品中加入稀硫酸后,立即点燃D处的酒精灯,可能造成的结果是发生爆炸。
[实验验证]
为证明蓝色溶液中可能存在CuSO4和H2SO4,取少量蓝色溶液于试管中,加入过量打磨过的锌片,锌片与稀硫酸反应生成硫酸锌和氢气,与硫酸铜溶液反应生成红色的铜和无色的硫酸锌溶液,故有:
实验操作 | 实验现象 | 实验结论 |
取少量蓝色溶液于试管中,加入过量打磨过的锌片 | 有气泡产生 | 溶质中一定含有H2SO4 |
有红色物质析出, 蓝色溶液逐渐变成无色 | 溶质中一定含有CuSO4 |
上述反应后溶液中还存在的金属离子是锌离子,符号为Zn2+。
[拓展提升]
加热条件下,铜与氧气反应生成红色氧化铜,铜与硝酸银溶液反应生成蓝色硝酸铜溶液和银白色的银;故有:
序号 | 方法 | 现象 | 结论 |
1 | 取样,空气中灼烧 | 表面变黑并擦拭不掉 | 为假黄金 |
2 | 取样,放人硝酸银溶液中 | 溶液变蓝,样品表面有银白色固体物质生成 |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醛(CH2O) 为无色有刺激性气味的气体,极易溶于水,是重要的工业原料。由于甲醛影响人体健康,国家标准规定室内甲醛浓度不高于0.08 mg/m。下面介绍几种吸收甲醛的方法。
活性炭包活性炭内部有大量细微孔道,可吸附甲醛。
空气净化器其内置主要有电机和滤网。电机可加快抽入气体的循环流动速度。滤网除活性炭滤网外,还有静电驻极过滤网、光触媒滤网等。静电驻极过滤网靠静电力捕获带电微粒,但不能捕获甲醛。光触媒滤网在紫外线照射下产生氧化能力极强的物质,该物质可杀菌和分解甲醛等有机污染物。
植物某小组在3个密闭容器内分别放入吊兰、绿萝和芦荟,测定0 ~ 24 h甲醛的浓度,计算不同植物对甲醛的去除率(见表),比较其吸收效果,并绘制了吊兰的吸收曲线(如图)。柚子皮和菠萝不具有吸附性,也不与甲醛反应,常温下只能靠自身的气味掩盖甲醛的味道。
吊兰 | 绿萝 | 芦荟 | |
0 h时甲醛的 浓度(mg/m3) | 0.88 | 0.80 | 1.13 |
24 h时甲醛的 浓度(mg/m3) | 0.13 | 0.07 | 0.19 |
去除率(%) | 85.2 | 91.3 | 83.2 |
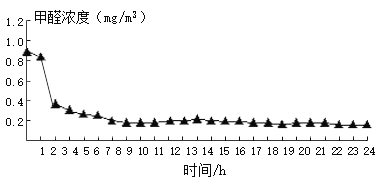
以上方法效果不一,可根据不同情况选用适合的方法。
依据文章内容,回答下列问题。
(1)甲醛(CH2O) 属于______(填序号,下同)。
A 混合物
B 化合物
C 氧化物
(2)空气净化器吸收甲醛比活性炭包效率高的原因是______(答1条即可)。
(3)依图分析,吊兰吸收效率最高的时间是______。
A 0 ~ 1 h
B 1 ~ 2 h
C 7 ~ 8 h
(4)依表判断,吸收效果最好的植物是______。
(5)下列说法正确的是______。
A 甲醛是重要的工业原料,但使用时需考虑其对环境的影响
B 空气净化器的每层滤网都可以吸收甲醛
C 本实验中,3种植物都不能使密闭容器内甲醛含量降低至国家标准以下
D 柚子皮和菠萝吸收甲醛的效果较好
【题目】如下图的加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热。实验小组针对放热过程中的反应原理展开探究。

(查阅资料)
常温下镁粉能与水发生置换反应,且放热。
(进行实验)
同学们用下图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8 mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:
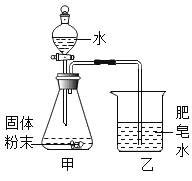
(实验时的室温为22.8℃)
实验序号 | A | B | C | D | E | F |
固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
乙中现象 | 少量肥皂泡,难以点燃 | ? | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡,点燃有爆鸣声 |
混合物温度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
(解释与结论)
(1)实验B,乙中现象为_______________。
(2)实验A证明了镁粉与水能反应,完成该反应的化学方程式Mg+2H2O=____+H2↑
(3)使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入_____________。
(反思改进)
(4)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,其可能的原因是___________。
(5)同学们根据实验结果进一步猜测,实验F中的反应结束后,甲中剩余固体混合物中仍然含有铁粉,检验其铁粉存在的的实验方案为:取少量固体混合物___________________。
(6)从上述实验初步得出“NaCl溶于水没有热量的变化”的结论,依据的两个实验是(填实验序号)______________