【题目】某校同学们开展金属化学性质的实验探究活动。
(1)某同学设计不同实验方案,验证铁和铜两种金属活动性
实验步骤 | 实验现象 | 实验结论 |
①分别取等量的铁片和铜片于两试管中,加入等量的稀硫酸 | ________ | 铁比铜活动性强 |
②________ | ________ |
(2)某小组做镁与稀硫酸反应实验时,发现该反应很剧烈,还观察到试管内产生“白雾”,即对“白雾”进行如下探究:反应过程中,“白雾” 产生的原因是________________________。写出镁与稀硫酸反应的化学方程式____________________。用燃着的木条放在试管口,可听到爆鸣声,但试管没有爆炸的原因是____________________。
[提出问题]实验过程中,大家只听见氢气燃烧的爆鸣声而没有看见火焰,小组讨论如何实现氢气持续地燃烧并看见淡蓝色火焰呢?
[查阅资料]水蒸的存在,对氢气燃烧火焰的传播有很明显的阻滞作用,即水蒸气浓度越高,火焰传播的速度越慢。
[设计实验]经老师指导,同学们将实验进行了改进,如图所示。
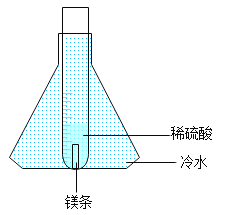
[实验操作]取0.3 g镁条放入装有5.0 g稀硫酸的试管中,将试管放入盛有冷水的锥形瓶中,反应开始后,用燃着的木条点燃试管口的氢气,观察到氢气持续燃烧,火焰呈现淡蓝色。
[解释与反思]①锥形瓶中冷水的作用是__________。
②在实验冷却恢复室温的过程中,同学们还发现镁条消失一段时间后试管内部产生了白色晶体。对此“意外”的现象,你的解释是________。请计算此时溶液中溶质的质量分数为________(列出计算式即可)。(室温下硫酸镁的溶解度为33.5 g)
【题目】为测定久置于空气中的氢氧化钠样品的变质程度,某化学活动小组称取该固体样品6.5g放入锥形瓶中,加水溶解,配成50g溶液,再向锥形瓶中滴加稀硫酸,反应过程中产生气体质量的部分实验数据和锥形瓶中溶液质量变化的图象如表所示:
加入稀硫酸的质量/g | 40 | 65 | 75 |
产生气体的质量/g | 1.1 | 2.2 | 2.2 |
(1)6.5g样品与稀硫酸完全反应产生气体的质量是________g。
(2)6.5g样品中碳酸钠的质量分数是________。(结果精确至0.1%)
(3)以上三次的实验数据中,只有一次加入的稀硫酸与锥形瓶中溶液的溶质恰好完全反应。
①如图图象中a的数值是________。
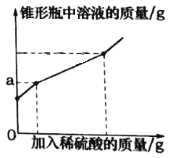
②求该实验中所用稀硫酸的溶质质量分数____。(写出计算过程)