题目内容
【题目】为测定一瓶NaOH溶液是否完全变质,分别取该溶液于A、B两个密闭容器中,将一定浓度的稀盐酸滴加到A中,利用二氧化碳传感器测定二氧化碳浓度变化情况,结果如图4所示;将一定浓度的氯化钙溶液滴加到B中,利用pH传感器测定溶液pH变化情况,结果如图5所示。下列实验结论不正确的是
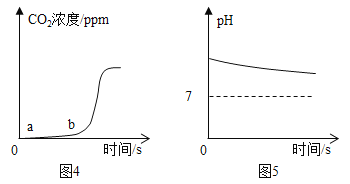
A.说明NaOH溶液是部分变质
B.图4中ab段主要发生中和反应
C.图5随着氯化钙溶液不断加入,pH不可能等于7
D.根据图5,反应结束时,溶质只有NaCl
【答案】D
【解析】
由题意由图4 可知,a点到b点之间,较长时间内未明显产生CO2,说明滴加的稀盐酸主要与溶液中的氢氧化钠发生反应,b点之后曲线开始明显上升,反应产生较多的二氧化碳,说明溶液中有碳酸钠,由图5可知,随着氯化钙溶液的滴加,与之反应的是碳酸钠,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,而反应结束pH仍大于7,因此剩余碱性物质就是部分变质后没有参与反应的氢氧化钠,则有:
A、结合以上分析可知,这瓶NaOH溶液部分变质,A选项结论正确,不符合题意;
B、a点到b点曲线说明在部分变质的氢氧化钠溶液中,稀盐酸先与氢氧化钠反应,主要发生中和反应,B选项结论正确,不符合题意;
C、随着氯化钙溶液的滴加,虽然Na2CO3和CaCl2发生反应生成氯化钠溶液呈中性,但是还有部分氢氧化钠未变质,相当于氢氧化钠溶液会被稀释,pH逐渐降低,但溶液仍呈碱性,故pH不可能等于7,C选项结论正确,不符合题意;
D、烧杯B滴加氯化钙溶液后,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,氢氧化钠不反应,因此反应结束时,溶质应为NaCl 和NaOH,D选项结论不正确,符合题意。故选D。

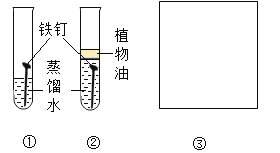
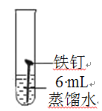
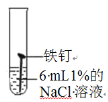
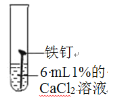
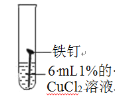
【题目】某兴趣小组发现铁钉生锈速率较慢,询问老师如何加快铁钉生锈的速率。老师提出氯化 物可能加快铁钉生锈的速率。
(提出问题)氯化物对铁钉生锈有怎样的影响?
(实验探究一)探究氯化物对铁钉生锈速率的影响。
试管编号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
现象 | 2天后,铁钉表面出现红色 | 1天后, 铁钉表面出现红色 | 1天后,铁钉表面出现红色 | 7分钟时铁钉表面出出现红色20分钟后试管底部出现红色沉淀 |
(1)分析实验①②③可以得到的结论是氯化物______(填“能”或“否”)加快铁生锈。
(2)小组同学认为,试管④中的红色沉淀可能是铁锈,也可能是铜。他们认为红色沉淀可能是铜的理由是_____(用化学方程式解释)。
(实验探究二)探究试管④中红色沉淀的物质组成。
实验步骤 | 实验操作 | 实验现象 |
I | 将试管④中的红色固体加入试管中,再向试管中加入足量的 | 红色固体大部分溶解,溶液变为黄色 |
II | 将步骤I所得的混合物过滤,洗涤、干燥滤纸上的固体后,置于石棉网上加热 | 红色固体变黑 |
III | 将步骤II所得的黑色固体置于管中,再加入足量稀硫酸 |
(3)步骤Ⅰ中所加入的试剂是______。
(4)步骤Ⅲ中观察到的实验现象是_____。
(5)由实验探究二分析试管④中红色沉淀的物质组成是________(填字母)。
A 只有铁锈 B 只有铜 C 铁锈和铜
(反思与应用)
(6)综上,该小组推测氯化物与铁钉生成的金属能进一步加快铁钉生锈,则在等体积、等浓度的 NaCl 溶液中,铁铜合金的生锈速率_____(填“快于”或“慢于”)纯铁的生锈速率。
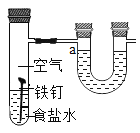
【题目】为探究某物质 X 对钢铁在潮湿环境下的腐蚀的影响作用,某同学进行了如下实验:
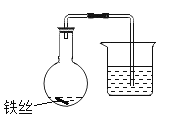
① 选择 6 个容量相同的烧瓶,分别编号为 1~6,加入规格、质量相同的铁丝。
② 向 1~3 号瓶中放入 2mL 清水,向 4~6 号瓶中放入 2mL10%X 的水溶液,将铁丝润湿。
③ 塞上带有导管的塞子,将导管末端浸入盛有水的烧杯中,记录导管内液面的初始位置(如图所示)。
④ 放在室温环境下,每隔一小时测量一次,周期为 3 小时,记录数据。结果如下表所示:
时间(小时) | 1 号瓶 | 2 号瓶 | 3 号瓶 | 4 号瓶 | 5 号瓶 | 6 号瓶 |
0 | 0 | 0 | 0 | 0 | 0 | 0 |
1 | 0 | 0.1 | 0 | 1.2 | 1.4 | 0 |
2 | 0.8 | 0.7 | 0.9 | 5.6 | 5.7 | 0.1 |
3 | 3.5 | 3.2 | 3.7 | 9.8 | 10.0 | 0.1 |
注:放置过程中导管内液面上升情况(单位:cm)
(1)在该项探究中,要取同样处置的 3 只烧瓶的目的是_。
(2)6 号瓶的数据明显与 4、5 号瓶不同,可能原因是_。
(3)通过本实验,可初步得出的结论是_。
(4)该项探究的设计是否存在不足_?如何改进_?