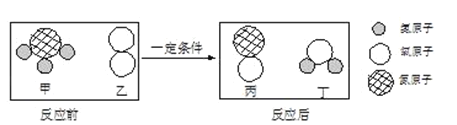
【题目】向氢氧化钠溶液中通入二氧化碳,反应的化学方程式为________,实验没有明显现象,若要证明两者发生了化学反应,你采取的实验方法是_______。
(1)但某同学在常温下向饱和的氢氧化钠溶液中通入二氧化碳时,发现溶液中出现了白色沉淀。同学们对此现象产生了浓厚的兴趣,准备对产生此现象的原因进行探究。
(查阅资料)①常温下部分物质的溶解度
物质名称 | 氢氧化钠 | 碳酸钠 | 碳酸氢钠 |
溶解度(单位:g) | 109 | 21.5 | 9.6 |
②在碳酸钠溶液中不断通入二氧化碳可发生如下反应:Na2CO3+CO2+H2O=2NaHCO3
③碳酸氢钠溶液显碱性。
(提出问题)产生的白色沉淀是什么?
(提出猜想1)猜想①:可能是碳酸钠;猜想②:可能是碳酸氢钠;猜想③:可能是________
(设计实验1)小明向白色沉淀中加入大量水溶解得到溶液。向溶液中加入过量氯化钡溶液,观察到_____,过滤,向滤液中加入________,观察到溶液变为红色,得出结论猜想③成立。
(进一步探究)在氢氧化钠溶液中通入二氧化碳产生沉淀物与什么因素有关?
(提出猜想2)猜想①:可能与氢氧化钠溶液的浓度有关;猜想②:可能与通入的CO2气体量的多少有关。
(设计实验2)
(2)请帮助小明设计实验验证猜想①是否成立。
你的实验方案是:________
实验现象:________
实验结论:与NaOH溶液的浓度有关。
(3)进一步实验发现与通入的CO2气体量的多少也有关,最终得出猜想②也成立。
(拓展提升)向饱和的碳酸钠溶液中通入CO2气体,也有白色沉淀生成。
(4)分析生成沉淀的原因______,根据实验结论,写出一种鉴别饱和碳酸钠和碳酸氢钠溶液的方法____
(5)实验发现常温下,在一定溶质质量分数的碳酸钠溶液中通入足量的二氧化碳就能出现沉淀现象,该碳酸钠溶液的溶质质量分数应高于______(计算结果精确到0.1%)。