题目内容
【题目】甲和乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )
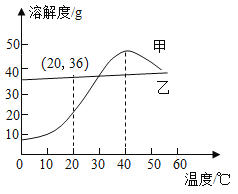
①甲的溶解度随温度的升高而增大
②40℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法
③20℃时,向125g溶质质量分数为20%的乙溶液中加入15g乙固体并振荡,有固体不溶解
④将相同质量的甲和乙的饱和溶液分别从40℃降温至10℃,甲析出晶体的质量大
A. ①②B. ③④C. ①③④D. ②③④
【答案】D
【解析】
①通过分析溶解度曲线可知,小于40℃时,甲的溶解度随温度的升高而增大,故①错误;
②小于40℃时或大于40℃时,甲物质的溶解度随温度的降低、升高时,溶解度都会减少,所以40℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法,故②正确;
③20℃时,乙物质的溶解度是36g,根据溶解度概念可知,100g水中最多溶解36g乙,125g溶质质量分数为20%的乙溶液中含有溶质质量=125g×20%=25g,含有水100g,加入15g乙固体并振荡,有固体不溶解,故③正确;
④将相同质量的甲和乙的饱和溶液分别从40℃降温至10℃,甲物质的溶解度变化较大,所以甲析出晶体的质量大,故④正确。叙述正确的是②③④。故选D。

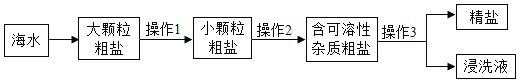
【题目】日常生活中,每位同学都会接触到硬水。咸宁市某校化学兴趣小组的同学在老师的带领下对硬水进行了一些探究和拓展实验。
(查阅资料)水的硬度是由水中溶解的可溶性钙和镁化合物引起的,硬水中溶解的钙和镁化合物可分为两类:钙、镁的碳酸氢盐;钙、镁的硫酸盐或氯化物,一般所说的水的硬度是由上述两类化合物引起的。
(1)日常生活中常用煮沸的方法将硬水软化,这种方法可靠吗?小组同学设计了如下模拟实验。
实验序号 | 实验操作 | 实验现象 |
Ⅰ | 分别取适量碳酸氢钙溶液和氯化钙溶液于A、B两支试管中,同时加热 | A试管中产生气泡,有沉淀生成,B试管中无明显现象。 |
Ⅱ | 冷却后,在上述实验后两支试管中,分别滴加几滴肥皂水,振荡 | ①_____(填“A”或“B”)试管中有较多泡沫,另一支试管中泡沫较少。 |
实验结果:用煮沸的方法可以降低水的硬度。
(2)小组同学对硬水中为什么含有碳酸氢钙非常感兴趣,于是再次学习九年级化学下册课本中的资料卡片:石笋和钟乳石的形成。知道了当石灰岩遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O═Ca(HCO3)2
小组同学思考:若向碳酸钠溶液中通入一定量的二氧化碳,是否也能生成碳酸氢钠?
于是他们对此开始实验探究(不考虑二氧化碳和碳酸作为溶质的情况)
(提出问题)所得溶液中溶质是什么?
(提出猜想)
猜想一:溶质为Na2CO3;猜想二:溶质为 NaHCO3;猜想三:溶质为②_____。
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
a.取所得溶液少许于试管中,向其中滴加过量的CaCl2溶液 | 有白色沉淀生成 | 猜想二③_____ (填“成立”或“不成立”) |
b.取实验步骤a中上层清液,滴加适量稀盐酸 | 有气泡冒出 | 猜想一不成立 |
写出实验步骤b中发生反应的化学方程式④_____。
通过实验,小组同学得出了正确结论。
(3)热水瓶用久后,瓶胆内壁常附着一层水垢,老师说其成分主要是碳酸钙、氢氧化镁等。小组同学认为可使用稀盐酸除去,请写出发生中和反应的化学方程式⑤_____。
(4)小组同学还对稀盐酸和氢氧化钠溶液发生中和反应进行了如下探究:
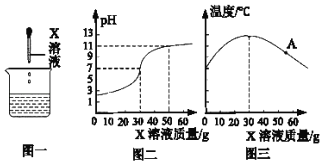
用pH传感器测得烧杯内溶液的pH变化图象(如图二),同时用温度传感器测得烧杯内温度变化图象(如图三),实验过程中保温良好,忽略热量散失。
Ⅰ.请分析图三,能得到什么结论⑥_____。
Ⅱ.图三中A点对应溶液的溶质成分是⑦_____ (填写化学式)。
【题目】A、B、C是金属活动性顺序表中的三种金属。取形状大小相同的A、B、C三种金属,分别向其加入同体积同溶质质量分数的稀盐酸,实验现象如下表所示,请回答:
实验 |
|
|
|
现象 | 速率快,产生大量气泡 | 速率缓慢,产生气泡较少 | 无现象 |
(1)A、B、C三种金属的活动性由强到弱的顺序是_________(填字母)。
(2)将金属C放入硝酸银溶液中,其表面有银析出,写出该反应的化学方程式__________。
(3)向金属A反应后的溶液中滴入几滴紫色石蕊试剂,溶液变红色。则此溶液的pH_____(填“>”“<”或“=”)7。再向该溶液中滴加NaOH溶液,溶液由红色变为紫色,发生的化学反应方程式为_______。
【题目】某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
(查阅资料)
经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为_____。
(对比实验)
编号 | 操作 | 现象 |
甲 | 将表面未打磨的铝丝浸入CuSO4溶液中 | 无明显现象 |
乙 | 将表面打磨后的铝丝浸入CuSO4溶液中 | 铝丝表面析出红色固体 |
丙 | 将表面未打磨的铝丝浸入CuCl2溶液中 | 铝丝表面析出红色固体 |
(1)比较实验乙和实验_____(填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为_____,据此可知金属活动性Al比Cu_____(填“强”或“弱”)。
(3)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是_____。
(猜测与探究)
小组同学针对实验丙的现象,经讨论后猜测:Cl-破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
操作 | 现象 | 结论 | 推论 |
(1)向一支试管中再加入 NaCl固体 | 铝丝表面析 出红色固体 | 氧化铝薄膜 被破坏 | Na+或①_____能 破坏氧化铝薄膜 |
(2)向另一支试管中再加入 Na2SO4固体 | ②_____ | 氧化铝薄膜 未被破坏 | Na+和SO42都不能 破坏氧化铝薄膜 |
(结论与反思)
得出结论:前述猜测_____(填“正确”或“不正确”)。总结反思:本次探究充分运用了比较法和控制变量法。
【题目】今年“五·一”假期,小丽随爸爸到乡下省亲,期间看到许多漂亮的大理石,于是好带了一些回来,想去学校实验室测定这此大理石中CaCO3的含量。他称取了20克大理石样品置于烧杯中,然后将250g稀盐酸分成五等份,依次加入烧杯充分反应,记录有关实验数据如下表所示(大理石中其他分均不溶于水,也不参与化学反应)。
加入次数 | 一 | 二 | 三 | 四 | 五 |
加入稀盐酸的质量 | 50 | 50 | 50 | 50 | 50 |
烧杯中剩余固体的质量 | 15 | 10 | 5 | 5 | m |
试求:(1)m的值应为_____;
(2)实验中大理石样品所含CaCO3的质量分数?_____
(3)实验中所用稀盐酸的溶质质量分数?_____