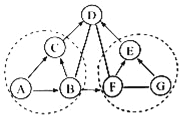
【题目】(1)在室温条件下,对100mL氯化钠饱和溶液进行如图所示操作:

a.最终甲、乙两烧杯中溶液一定是饱和溶液的是_____。
b.乙溶液在加50mL水的过程中,下列这些量逐渐减小的是_____。
①溶解度 ②溶质质量分数 ③溶剂的质量 ④溶液的密度
(2)提纯含少量泥沙的粗盐样品,实验过程和氯化钠的溶解度数据如下:

温度(℃) | 溶解度(g) |
20 | 36.0 |
40 | 36.6 |
60 | 37.3 |
①20℃时氯化钠的溶解度是_____
②该实验是利用泥沙难溶于水而氯化钠_____的性质进行提纯,操作Ⅲ的名称是_____。
③关于蒸发叙述正确的是_____(选填编号)。
a、蒸发是通过加热的方法将水汽化除去
b、所需仪器为酒精灯、蒸发皿、温度计
c、搅拌可以防止蒸发过程中液滴飞溅
d、加热过程中用试管夹夹住蒸发皿移动,使其均匀受热
④溶解时,加入水的合适的量约为_____(选填“15”、“30” 或“60”)mL。
【题目】“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。
探究活动一:认识工具
如下图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。
部分酸、碱和盐的溶解性表(室温)
阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| 乙 | 丙 | |||
| 甲 | 丁 | 戊 |
(1)认识符号:NO3-名称是________;
(2)写化学式:丙物质的化学式是________;
(3)物质分类:五种物质中,属于碱的是________(用化学式表示);
(4)溶解能力:五种物质中,只有一种不溶于水,它是________(用化学式表示)。
探究活动二:运用工具
有一包白色粉末可能含有氯化钡、碳酸钡、碳酸钠、氢氧化钠和硫酸钠中的一种或几种,取一定量该粉末样品加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色不溶物,小郑同学将烧杯中的物质过滤,得滤渣A和滤液B,取滤渣A于试管中滴加过量稀硝酸,观察到滤渣全部溶解,有气泡产生。
小杨同学进一步设计了如下实验方案,确定白色粉末的组成:

针对上述实验方案中各步骤的现象,小杨同学提出下列三种不同的假设,依据每种假设中各步骤不同的实验现象,可得出不同的实验结论。
步骤一 | 步骤二 | 步骤三 | |
假设一 | 有白色沉淀生成 | ||
无白色沉淀生成 | 溶液变红 | 溶液变为无色 | |
假设三 | 无白色沉淀生成 | 无明显现象 | 无明显现象 |
(1)依据假设一的现象,可确定原白色粉末中只含有碳酸钡、碳酸钠、氢氧化钠和硫酸钠四种物质。则步骤二的现象是________;步骤三中发生的任意一个化学反应的化学方程式是________。
(2)依据假设二的现象,原白色粉末可能的组成是________。(任写一种可能的组成,用化学式表示);
(3)依据假设三的现象,原白色粉末可能的组成有________种。
【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液,化学小组的同学经过询问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:

(进行猜想)
猜想Ⅰ:原溶液的溶质是NaCl; 猜想Ⅱ:原溶液的溶质是NaOH;
猜想Ⅲ:原溶液的溶质是Na2CO3; 猜想Ⅳ:原溶液的溶质是NaHCO3。
标签破损残缺的原因是________。
(查阅资料)常温下,有关物质的相关信息如表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,原溶液的溶质一定不是________。
(进行实验)
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是________。
(2)同学们另取样品又进行了如下实验,实验过程如下:

①生成白色沉淀A的化学方程式________。
②通过实验可以判断样品无色溶液中含有的溶质有________。
(获得结论)
实验完成后,最终得到的结论:原瓶中的溶质是________,且已变质。