题目内容
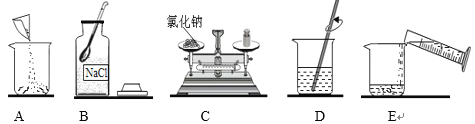
【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液,化学小组的同学经过询问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:
(进行猜想)
猜想Ⅰ:原溶液的溶质是NaCl; 猜想Ⅱ:原溶液的溶质是NaOH;
猜想Ⅲ:原溶液的溶质是Na2CO3; 猜想Ⅳ:原溶液的溶质是NaHCO3。
标签破损残缺的原因是________。
(查阅资料)常温下,有关物质的相关信息如表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,原溶液的溶质一定不是________。
(进行实验)
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是________。
(2)同学们另取样品又进行了如下实验,实验过程如下:
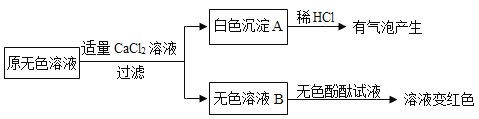
①生成白色沉淀A的化学方程式________。
②通过实验可以判断样品无色溶液中含有的溶质有________。
(获得结论)
实验完成后,最终得到的结论:原瓶中的溶质是________,且已变质。
【答案】倾倒药品时,标签没有朝向手心 NaHCO3 氯化钠 CaCl2+Na2CO3=CaCO3↓+2NaCl Na2CO3、NaOH NaOH
【解析】
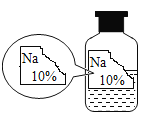
[进行猜想]根据图示可以看出,标签被腐蚀了,那么有可能在倾倒药品时,标签没有朝向手心,留下来的液体药品腐蚀标签。故答案为:倾倒药品时,标签没有朝向手心;
[进行实验]根据图示提示可以知道,该溶液的溶质质量分数为10%。根据已给的溶解度分析出,溶解度表述的是在100g水中达到饱和状态时可以溶解该物质的质量。通过定义可以计算出,NaCl的饱和溶液的质量分数约为26.5%,NaOH的饱和溶液的质量分数约为52.2%,Na2CO3的饱和溶液的质量分数约为17.7%,NaHCO3的饱和溶液的质量分数约为8.76%。故原溶液的溶质一定不是碳酸氢钠。故答案为:NaHCO3;
[进行实验](1)测定溶液的pH大于7,而氯化钠溶液呈中性,pH等于7,所以原溶液的溶质一定不是氯化钠。故答案为:氯化钠;
(2)①适量的氯化钙溶液可以检验并除尽碳酸钠,碳酸钠可以和氯化钙反应生成碳酸钙沉淀和氯化钠。故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl;
②滴加无色酚酞溶液,溶液变红,说明溶液呈碱性。说明样品无色溶液中含有氢氧化钠。所以原无色溶液中含有的溶质有NaOH、Na2CO3。故答案为:NaOH、Na2CO3;
[获得结论]通过上述内容可以分析出,该瓶原来装的无色溶液的溶质是NaOH,并且部分药品已经变质。故答案为:NaOH。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案【题目】下列图像不能正确反映其对应操作的是
A | B | C | D |
|
|
|
|
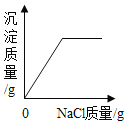
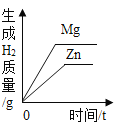
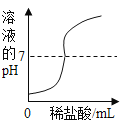
在一定量的AgNO3溶液中逐滴加入NaCl溶液 | 等质量Zn和Mg分别与足量的等浓度稀硫酸反应 | 向NaOH溶液中逐滴加入稀盐酸 | 等质量CaCO3分别与足量的等浓度稀盐酸反应 |
A. A B. B C. C D. D