【题目】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4。
(查阅资料)草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O43H2O![]() CO2↑+CO↑+3H2O,碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。铁的常见氧化物中铁的质量分数:
CO2↑+CO↑+3H2O,碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(问题讨论)为了测定铁红中铁元素的质量分数,小组间学进行如下实验。(装置气密性良好)

(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是_____(填字母序号)
a.浓硫酸 b.澄清的石灰水 c氢氧化钠溶液
(2)写出E装置中所发生反应的一个化学方程式:_____。
(3)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则_____<m<_____。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是_____。
(实验反思)
(4)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会_____(选填“偏小”“不变”“偏大”)。
(5)该实验装置的一个明显缺陷是_____。
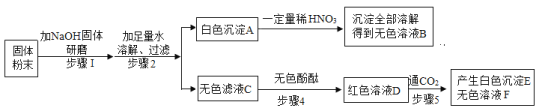
【题目】某化学兴趣小组为“探究纯碱的性质”中,同学们做了如图所示的四组实验,并将A、B、C、D四支试管中反应后的废液全部倒入一个洁净的大烧杯中。一段时间后发现,烧杯上层得到无色澄清的溶液。为了探究该溶液的成分,进行了以下实验。
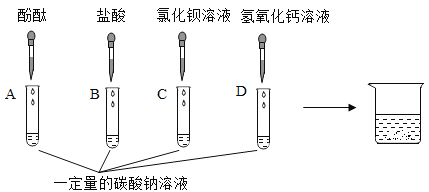
(提出问题)大烧杯中的上层溶液中除了含有水和酚酞外,还含有哪些物质?
(猜想假设)猜想一:NaCl、BaCl2、CaCl2 猜想二:NaCl、BaCl2、CaCl2、HCl
猜想三:NaCl、BaCl2、CaCl2 、Ca(OH)2 猜想四:NaCl、BaCl2、CaCl2、Na2CO3
(分析讨论)上述猜想中一定错误的是猜想三和_____(填序号),为说明上述的原因,请用一个化学方程式解释为_____。
(设计实验)为进一步确定上层溶液中溶质的成分。另三个同学设计如下实验方案,进行探究:
实验操作 | 实验现象 | 实验结论 |
实验一:取大烧杯中上层溶液少许于一支试管中,滴加少量的石蕊试剂。 | 溶液变成_____色 | 猜想二正确。 |
实验二:取大烧杯中上层溶液少许于一支试管中,逐滴滴加碳酸钠溶液至过量。 | 有气泡产生,并有白色沉淀生成,_____; | 猜想二正确。 |
实验三:取大烧杯中上层溶液少许于一支试管中,滴加少量的硝酸银溶液。 | 产生白色沉淀 | 猜想二正确。 |
(交流讨论)大家讨论后得出,实验三结论是不严谨的,原因是_____。
(实验结论)通过上述探究,猜想二是正确的。