题目内容
【题目】某化学兴趣小组为“探究纯碱的性质”中,同学们做了如图所示的四组实验,并将A、B、C、D四支试管中反应后的废液全部倒入一个洁净的大烧杯中。一段时间后发现,烧杯上层得到无色澄清的溶液。为了探究该溶液的成分,进行了以下实验。
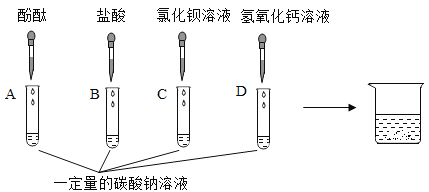
(提出问题)大烧杯中的上层溶液中除了含有水和酚酞外,还含有哪些物质?
(猜想假设)猜想一:NaCl、BaCl2、CaCl2 猜想二:NaCl、BaCl2、CaCl2、HCl
猜想三:NaCl、BaCl2、CaCl2 、Ca(OH)2 猜想四:NaCl、BaCl2、CaCl2、Na2CO3
(分析讨论)上述猜想中一定错误的是猜想三和_____(填序号),为说明上述的原因,请用一个化学方程式解释为_____。
(设计实验)为进一步确定上层溶液中溶质的成分。另三个同学设计如下实验方案,进行探究:
实验操作 | 实验现象 | 实验结论 |
实验一:取大烧杯中上层溶液少许于一支试管中,滴加少量的石蕊试剂。 | 溶液变成_____色 | 猜想二正确。 |
实验二:取大烧杯中上层溶液少许于一支试管中,逐滴滴加碳酸钠溶液至过量。 | 有气泡产生,并有白色沉淀生成,_____; | 猜想二正确。 |
实验三:取大烧杯中上层溶液少许于一支试管中,滴加少量的硝酸银溶液。 | 产生白色沉淀 | 猜想二正确。 |
(交流讨论)大家讨论后得出,实验三结论是不严谨的,原因是_____。
(实验结论)通过上述探究,猜想二是正确的。
【答案】猜想四 BaCl2+Na2CO3═BaCO3↓+2NaCl(或CaCl2+Na2CO3═CaCO3↓+2NaCl) 红 溶液变红色 只要溶液中含有氯离子,加入硝酸银都能够产生白色沉淀
【解析】
[分析讨论]
上述猜想中一定错误的是猜想三和猜想四,是因为氢氧化钙溶液和碳酸钠溶液都是显碱性溶液,都能使酚酞试液变红色,而上层得到无色澄清的溶液。
故填:猜想四。并且碳酸钠和氯化钡、氯化钙不能共存,反应生成碳酸钡、碳酸钙沉淀和氯化钠,反应的化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl、CaCl2+Na2CO3═CaCO3↓+2NaCl。
故填:BaCl2+Na2CO3═BaCO3↓+2NaCl(或CaCl2+Na2CO3═CaCO3↓+2NaCl)。
[设计实验]
实验一:取大烧杯中上层溶液少许于一支试管中,滴加少量的石蕊试剂,溶液变红色,说明溶液显酸性,即溶液中含有盐酸。
故填:红。
实验二:取大烧杯中上层溶液少许于一支试管中,逐滴滴加碳酸钠溶液至过量,有气泡产生,是因为碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,并有白色沉淀生成,是因为碳酸钠和氯化钡、氯化钙反应生成碳酸钡、碳酸钙沉淀和氯化钠,溶液变红色,是因为过量的碳酸钠溶液显碱性,能使酚酞试液变红色。
故填:溶液变红色。
[交流讨论]
实验三结论是不严谨的,这是因为只要溶液中含有氯离子,加入硝酸银都能够产生白色沉淀。
故填:只要溶液中含有氯离子,加入硝酸银都能够产生白色沉淀。