题目内容
【题目】将1.80g氯化铜样品(杂质不溶于水,也不参加反应)跟一定量的氢氧化钠溶液恰好完全反应,过滤后得到溶质质量分数为20.0%的溶液5.85g。已知氯化铜与氢氧化钠溶液反应的化学方程式为:CuCl2+2NaOH =Cu(OH)2↓+2NaCl
求:(1)样品中氯化铜的质量_____;
(2)加入氢氧化钠溶液的质量_____。
【答案】1.35g 5.48g
【解析】
氯化铜与一定量的氢氧化钠溶液恰好完全反应,所得溶液为氯化钠溶液,根据得到溶溶质质量分数为20.0%的溶液5.85g,计算出反应生成氯化钠的质量,根据反应的化学方程式,由氯化钠的质量可计算样品中氯化铜的质量及所消耗氢氧化钠溶液中氢氧化钠的质量和生成氢氧化铜的质量,及一步求解样品中氯化铜的质量和加入氢氧化钠溶液的质量。
解:(1)由题意得,生成NaCl的质量为5.85g×20.0%=1.17g,设样品中CuCl2的质量为x,生成氢氧化铜的质量为y,
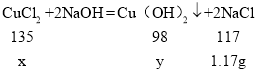
![]() x=1.35g,
x=1.35g,
![]() y=0.98g,
y=0.98g,
(2)NaOH溶液的质量为:5.85g+0.98g-1.35g=5.48g,
答:(1)样品中CuCl2的质量为1.35g;
(2)NaOH溶液的质量为5.48g。

 互动英语系列答案
互动英语系列答案【题目】化学小组同学发现在面包制作过程中加入了一些白色粉末,使面包变得松软。同学们对白色粉末的成分进行探究。
(查阅资料)①经调查,市场上有以下3种主要产品。
商品名称 | 小苏打 | 食臭粉 | 混合碱性膨松剂 |
主要成分 | 碳酸氢钠 | 碳酸氢铵 | 碳酸氢钠和碳酸氢铵 |
②2NaHCO3![]() Na2CO3+H2O+CO2↑;NH4HCO3
Na2CO3+H2O+CO2↑;NH4HCO3![]() NH3↑+H2O+CO2↑;2NH3+H2SO4=(NH4)2SO4
NH3↑+H2O+CO2↑;2NH3+H2SO4=(NH4)2SO4
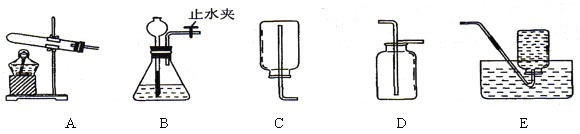
(实验准备)同学们选用下列实验装置,经组合进行实验:
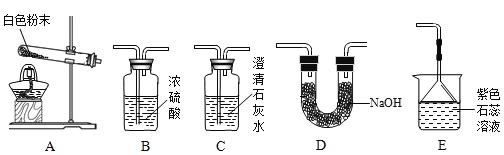
(实验记录)
实验序号 | 实验装置 | 实验现象 | 实验结论及分析 |
实验1 | 选用A、B、C | C中澄清石灰水变浑浊 | 有CO2生成,C中反应的化学方程式是_____ |
实验2 | 选用A、_____和E | E中紫色石蕊溶液变_____色 | 有NH3生成 |
(实验分析)
根据上述实验,甲同学认为该粉末的主要成分为食臭粉,乙同学认为上述实验不能确定该粉末为食臭粉。为进一步确认其组成及含量,同学们设计了如下定量实验:
实验序号 | 实验目的 | 实验装置 | 数据记录 | 实验结论 |
实验3 | 测定生成CO2的质量 | 选用A、B、D | 装置D增重ag | 该粉末为“混合碱性膨松剂” |
实验4 | 测定生成NH3的质量 | 选用A、D、B | 装置B增重1.7g |
(1)实验3中装置B的作用是_____。
(2)实验3中测得装置D增重ag,则a>_____g。
(3)若测得a为92.4,该碱性膨松剂中NaHCO3与NH4HCO3的质量比为_____