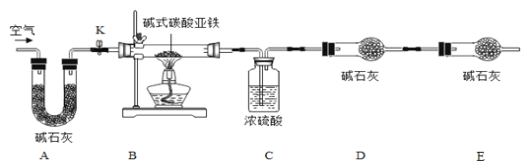
【题目】菱铁矿和赤铁矿一样,也是工业上冶炼铁的一种矿物。某种菱铁矿中铁元素的主要存在形式是碱式碳酸亚铁,为测定碱式碳酸亚铁[xFeCO3yFe(OH)2zH2O]的组成,华雪同在老师的指导下设计了如图实验装置:
(查阅资料)
a.碱式碳酸亚铁受热会完全分解生成FeO、CO2以H2O。
b.FeO是一种黑色粉末,它不稳定,在空气中加热,可被氧化成四氧化三铁。
c.碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O
(实验步骤)
(1)检查装置的_____后,准备称取3.40g碱式碳酸亚铁粉末放在装置B中,连接仪器。
(2)_____,鼓入一段时间空气,准确称量装置C、D、E的质量。
(3)关闭弹簧夹K,加热装置B至装置C中导管末端无气泡冒出,再打开弹簧夹K,缓缓通空气一段时间,这样操作的目的是_____。
(4)再次准确称量装置C、D、E的质量,所得数据如下
装置C/g | 装置D/g | 装置E/g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 200.36 | 180.88 | 180.00 |
(5)分析图、表中数据可知:3.40g碱式碳酸亚铁受热分解过程中生成H2O的质量为_____g,CO2的质量为_____g,装置E的作用是_____。
(实验结论)
在xFeCO3yFe(OH)2zH2O中,氢原子与氧原子的个数之比为_____。
(实验反思)
(1)装置A的作用是_____。
(2)实验结束后,装置B中的残留固体可能全部是FeO.也可能全部是Fe3O4.还可能是_____。
(3)为了得到装置B中残留固体的组成,华雪同学称得装置B中残留固体质量为2.24g后,通过计算可知:残留固体的组成及各成分的质量为_____。