题目内容
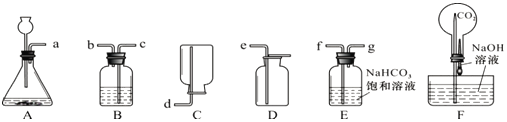
【题目】同学们总结了氧气和二氧化碳的实验室制法,并利用下列装置进行练习和拓展.
Ⅰ、知识总结:
(反应原理)
(1)用氯酸钾和二氧化锰混合加热制取氧气的化学方程式为_______________.
(气体制备)
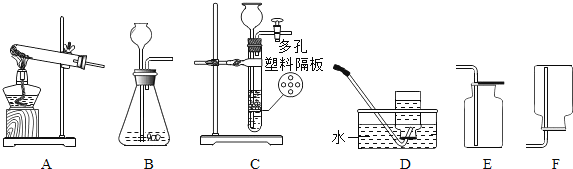
(2)氯酸钾和二氧化锰混合制取氧气,选择的发生装置为______(填编号,下同).
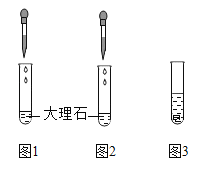
(3)用于大理石与稀盐酸制取二氧化碳的发生装置C优于B的原因是______.
(气体收集)
(4)实验室收集CO2的装置是______,选择的理由______.
(实验步骤及注意事项)氯酸钾和二氧化锰混合加热制取氧气过程中:
(5)A装置中试管口略向下倾斜的原因是______;用排水法收集氧气,开始收集的适宜时刻是______.
(气体验满)
(6)检验CO2是否收集满的方法是______.
(气体检验)
(7)检验瓶中气体是否为O2的方法是______.
Ⅱ、知识拓展:
请仔细观察下列装置的特点并回答相关问题:
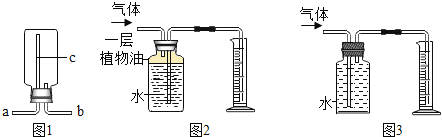
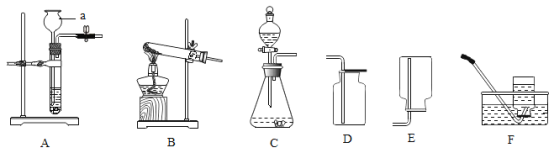
(8)①实验室若用图1装置收集氧气,则氧气应从______(口进入(填“a”或“b”);仪器c的名称是______.
②若要收集一定体积的二氧化碳气体,应选用______装置(填装置序号).
【答案】![]() A 关闭装置C中的止水夹,气体不能排出,试管内压强增大,液体被压入长颈漏斗中,试管内液面降低,固液分离,反应停止;打开止水夹后,气体排出,长颈漏斗中的液体进入试管中,试管中的液面升高,固液接触,反应又开始发生 E 二氧化碳的密度比空气大 防止冷凝水倒流至试管底部,炸裂试管 有均匀、连续的气泡冒出时 将点燃的木条放在集气瓶口处,若木条熄灭,证明二氧化碳已经集满 将带火星的木条伸入集气瓶中,若木条复燃,证明气体是氧气 b 直角导管 图2
A 关闭装置C中的止水夹,气体不能排出,试管内压强增大,液体被压入长颈漏斗中,试管内液面降低,固液分离,反应停止;打开止水夹后,气体排出,长颈漏斗中的液体进入试管中,试管中的液面升高,固液接触,反应又开始发生 E 二氧化碳的密度比空气大 防止冷凝水倒流至试管底部,炸裂试管 有均匀、连续的气泡冒出时 将点燃的木条放在集气瓶口处,若木条熄灭,证明二氧化碳已经集满 将带火星的木条伸入集气瓶中,若木条复燃,证明气体是氧气 b 直角导管 图2
【解析】
(1)氯酸钾在二氧化锰作催化剂、加热时发生反应生成氯化钾、氧气,反应的化学方程式为:![]() ;
;
(2)加热固体制取气体选择固体加热型装置,故氯酸钾和二氧化锰混合制取氧气,选择的发生装置为A。.
(3) 关闭装置C中的止水夹,气体不能排出,试管内压强增大,液体被压入长颈漏斗中,试管内液面降低,固液分离,反应停止;打开止水夹后,气体排出,长颈漏斗中的液体进入试管中,试管中的液面升高,固液接触,反应又开始发生。
(4) CO2易溶于水,不能用排水法收集,密度比空气大,可用向上排空气法收集,故实验室收集CO2的装置是E。
(5)A装置中试管口略向下倾斜的原因是防止冷凝水倒流,炸裂试管底部;用排水法收集氧气,开始收集的适宜时刻是有均匀、连续的气泡冒出时,此时是纯净的氧气。
(6) CO2一般不支持燃烧,气体的验满在瓶口处进行,故检验CO2是否收集满的方法是将燃烧的木条放在集气瓶口处,若木条熄灭,证明CO2已经集满。
(7) O2能使带火星的木条复燃,故检验瓶中气体是否为O2的方法是将带火星的木条伸入集气瓶中,若木条复燃,证明是O2。
(8)①氧气的密度比空气的密度大,进入以后占据下方空间,空气则被赶到上方空间而易从a端排出,氧气则从b端进入。仪器c的名称是直角导管。②CO2易溶于水,且能与水反应,在水上方加入少许植物油,能使CO2与水隔绝,故要收集一定体积的二氧化碳气体,应选用图2装置。

 名校课堂系列答案
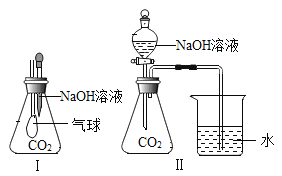
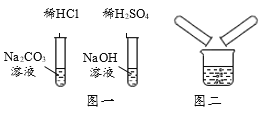
名校课堂系列答案【题目】某校化学兴趣小组在探究“酸碱盐的相关性质”时,做了如图一所示的两个实验,实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中(如图所示),观察到有气泡产生,为确认烧杯内溶液中溶质的成分,同学们进行了如下探究。
(查阅资料)Na2SO4溶液、NaCl溶液呈中性。
(提出猜想)猜想1:Na2SO4、NaCl;
猜想2:Na2SO4、NaCl和_____;
猜想3:Na2SO4、NaCl和H2SO4;
猜想4:Na2SO4、NaCl、H2SO4和Na2CO3。
(交流讨论)小强同学认为猜想4一定是错误的,他的理由是_____(用化学方程式表示)。
(进行实验)小明同学设计如下两个实验方案:
实验步骤 | 实验现象 | 实验结论 | |
方案一 | 取少量烧杯中的溶液于洁净的试管中,加入几滴紫色石蕊溶液 | _____ | 猜想3正确 |
方案二 | 取少量烧杯中的溶液于洁净的试管中,加入少量铁粉 | _____ |
请写出方案二中有关反应的化学方程式:_____。
(反思与总结)分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑反应物是否过量。