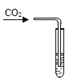
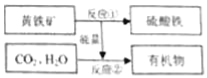
【题目】化学小组同学在课外读物中看到:“通常CO2可作灭火剂,但有些物质(如Na着火,不能用CO2熄灭”他们决定探究CO2与Na反应的产物。
[提出猜想]CO2与Na反应可能生成4种物质:C、CO、Na2O、Na2CO3
[查阅资料]
①Na是非常活泼的金属,常温下与O2、H2O等物质反应。②Na2O是白色固体,与H2O反应生成NaOH。
③向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀。
[实验过程]同学们在老师的指导下设计了如下图所示装置(部分夹持仪器已略去)

(1)实验记录
序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
① | 打开a,关闭b,由长颈漏斗注入稀盐酸 | A中产生大量气泡 E中出现浑浊 | A中反应的化学方程式为 _____ |
② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体;G中产生黑色沉淀 | 反应产物一定有 _____和_____ |
③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有_____; 反应的方程式为_____ |
(2)实验反思
①实验记录②中,E中出现浑浊,再点燃酒精灯的目的是_____;
②装置C内装的药品是_____,若无该装置,对实验有影响的物质是_____;
③检验第4种物质是否存在的实验方案:取D中白色固体于试管中,_____。
【题目】现有铜与金属X组成的混合物粉末,金属X是镁、铁、锌中的一种.利用该混合物进行如下实验:
实验步骤及数据:取该混合物粉末8.0g放入烧杯中,将140.0g 溶质质量分数为14.0%的稀硫酸平均分四次加入该烧杯中,充分反应后,测得烧杯内剩余固体的质量数据如下表:
加入稀硫酸的次数 | 第1次 | 第2次 | 第3次 | 第4次 |
烧杯内剩余固体质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
实验通过计算,求:
(1)该混合物粉末中铜的质量分数为_____;
(2)该混合物是由铜粉和_____组成的;
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?_____(写出计算过程)
(4)若用溶质的质量分数为98%、密度为1.84g/cm﹣3的浓硫酸来配制本实验中所用的稀硫酸,则需要取浓硫酸多少毫升?_____同时加入水多少毫升?_____(写出计算过程)
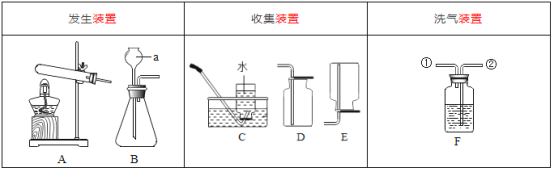
【题目】实验室提供下列药品:碳酸钠固体、块状大理石、粉末状大理石、稀硫酸、稀盐酸和浓盐酸;A、B、C、D、E、F、G、H等装置和试管等仪器.
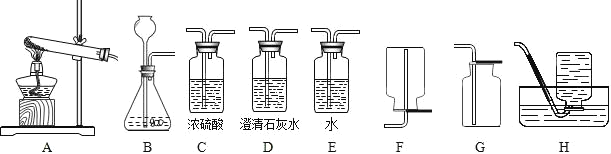
(1)制取CO2的发生装置选_____(填序号),按要求连接好装置后,在装入药品之前必不可少的操作_____.制CO2的装置还可以用来制取_____气体,其反应原理是:_____(用化学方程式表示).将装置A和装置H连接可制取我们常见的_____气体.
(2)检验二氧化碳的方法用化学方程式表示为_____.
(3)在四支试管中取等量固体和稀硫酸、稀盐酸反应,现象如表.
反应物 | ①粉末状大理石 +稀盐酸 | ②碳酸钠固体 +稀硫酸 | ③块状大理石 +稀盐酸 | ④块状大理石 +稀硫酸 |
现 象 | 剧烈,瞬间完成 | 剧烈,瞬间完成 | 有平稳气流产生 | 很慢,稍后停止 |
由此推知,实验室用于制取CO2的药品最合理的是_____(填序号);该反应的反应方程式为:_____.
(4)若要制取干燥的CO2,所有装置的连接顺序为_____.
(5)若不慎用浓盐酸代替稀盐酸制得了CO2气体,要得到纯净干燥的CO2,所有装置的连接顺序为_____.
【题目】某化学兴趣小组的同学对一包久置的生石灰(化学式为CaO)干燥剂产生了好奇,于是他们对这包干燥剂的成分展开了探究。
【资 料】生石灰与水发生的反应属于放热反应
【提出问题】这包干燥剂是否变质,成分是什么?
【猜想假设】
猜想一:全部是CaO;猜想二:是CaO和Ca(OH)2的混合物;猜想三:全部是Ca(OH)2;猜想四:是Ca(OH)2和CaCO3的混合物。
【实验探究】
(1)取部分该干燥剂于试管中,加水后无放热现象,说明这包干燥剂中不含________。
(2)继续向试管中滴加足量稀盐酸,有气泡出现,说明这包干燥剂中含有__________。
(3)为了进一步确定这包干燥剂中有无其他成分,小组同学设计了以下两种方案。
另取部分干燥剂于烧杯中,加水并搅拌,静置后取上层清液于2支试管中,请你参与实验并完成表中空白。
实验方案 | 方案一 | 方案二 |
实验操作 |
|
|
实验现象 | 溶液由无色变为红色,则溶液的PH______7 (填“﹤”“﹥” 或“﹦”) | 澄清溶液变浑浊 |
写出方案二发生的化学反应方程式_______________________________。
【实验结论】通过以上实验探究,得出猜想___________成立。