题目内容
【题目】现有铜与金属X组成的混合物粉末,金属X是镁、铁、锌中的一种.利用该混合物进行如下实验:
实验步骤及数据:取该混合物粉末8.0g放入烧杯中,将140.0g 溶质质量分数为14.0%的稀硫酸平均分四次加入该烧杯中,充分反应后,测得烧杯内剩余固体的质量数据如下表:
加入稀硫酸的次数 | 第1次 | 第2次 | 第3次 | 第4次 |
烧杯内剩余固体质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
实验通过计算,求:
(1)该混合物粉末中铜的质量分数为_____;
(2)该混合物是由铜粉和_____组成的;
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?_____(写出计算过程)
(4)若用溶质的质量分数为98%、密度为1.84g/cm﹣3的浓硫酸来配制本实验中所用的稀硫酸,则需要取浓硫酸多少毫升?_____同时加入水多少毫升?_____(写出计算过程)
【答案】52.5% 镁粉 16.6% 10.87m 120mL
【解析】
(1)铜在金属活动顺序中排在氢之后,铜与酸不能反应,反应后剩余固体质量4.2g即为其质量。该混合物粉末中铜的质量分数=![]() ;
;
(2)第一次所加稀硫酸140g÷4=35g完全反应时,消耗金属的质量=8.0g﹣6.8g=1.2g;
由于镁、铁、锌三种金属在反应中均呈+2价,设金属的相对原子质量为m,则
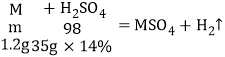
![]() m=24,所以金属为镁;
m=24,所以金属为镁;
(3)第三次加入硫酸后,一共加入了35g×3=105g硫酸
设:加入105g稀硫酸充分反应生成氢气的质量为x,生成硫酸镁的质量为y。

![]() x=0.3g,
x=0.3g,
![]() y=18g
y=18g
所得溶液的质量=(8.0g﹣4.4g)+105g﹣0.3g=108.3g;
溶质的质量分数=![]() 。
。
答:所得溶液中溶质的质量分数是16.6%
(4)1cm﹣3=1mL
设需要浓硫酸的质量为x
140.0g×14.0%=x×98% 解之得 x=20g
浓硫酸的体积=![]() ;
;
需要水的质量=140g﹣20g=120g;
水的密度为1g/cm﹣3,故需水的体积=![]() 。
。
答:需要取浓硫酸10.87mL,同时加入水120mL。