【题目】下表为氯化钠、碳酸钠在水中的溶解度。我国西北地区有很多咸水湖,其中最大的是柴达木盆地的察尔汗盐池。某盐湖附近的农民通过“冬天捞碱.夏天晒盐”获得大量湖盐。这里的“碱”指纯碱(主要成分是碳酸钠) ,盐指氯化钠。
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度 | 氯化钠 | 35.7 | 35.8 | 35.9 | 36.1 | 37.1 |
碳酸钠 | 7.0 | 12.5 | 21.5 | 39.7 | 49.0 | |
(1)请据图表简要解释“冬天捞碱,夏天晒盐”其中的道理____。
(2)小勤同学取该湖盐样品进行探究。
(提出问题)该湖盐样品的成分是什么?
(猜想与假设)猜想一:只有Na2CO3:猜想二:只有NaCl;猜想三:Na2CO3和NaCl。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
取少量样品于试管中,向其中加入足量的____溶液;过滤,得沉淀和滤液,向沉淀中加入足量稀硝酸 | 产生白色沉淀 部分白色沉淀消失 | 猜想三成立 |
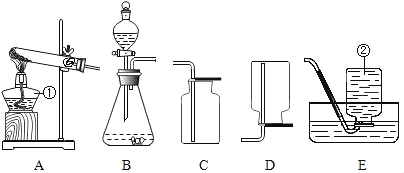
(拓展延伸)为进一步确定该湖盐样品中Na2CO3的质量分数,小勤同学再取该湖盐样品10.00g做了如图所示的补充实验(假定每步均完全反应或吸收)。

①反应结束之后通入足量空气的目的是_____。
②装置A中氢氧化钠溶液的作用是_____(用化学方程式表示)。
③实验结束后测得装置E增重0.44g,请根据上图所示的实验过程和提供的数据计算该湖盐样品中碳酸钠的质量分数是多少_____?(写出计算步骤,计算结果精确到0.1%)
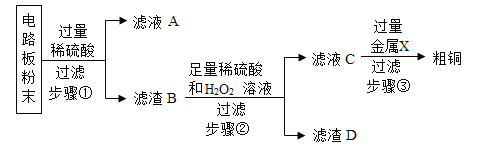
【题目】某化学兴趣小组在实验室里探究某些酸、碱、盐之间是否发生复分解反应。请你参与探究并填空:
(查阅资料)①硫酸铜和氯化铜的溶液都有毒。铜离子可以使蛋白质变性,可以杀死细菌和病毒,可以破坏人体细胞。②硫酸钠溶液呈中性,无毒。
(实验与探究)
内容 | 现象 | 实验解析 | 结论 | |
实验一 | 取少量稀盐酸于小试管中,滴入数滴碳酸钠溶液,振荡 | _____ | 化学方程式: Na2CO3+2HCl==2NaCl+H2O+CO2↑ | 生成物中有____或有____或有____生成时,复分解反应可以发生。 |
实验二 | 取少量氢氧化钠溶液于小试管中,滴入几滴酚酞试液振荡,液体呈现红色;再滴入足量的稀硫酸 | _____ |
| |
实验三 | 取少量氯化铜溶液于小试管中,滴入几滴氢氧化钠溶液试液,振荡 | _____ | 该反应的微观实质是:______; |
(废液处理)实验结束时,老师指出,废液定要进行无害化处理,尽量实现绿色排放(不考虑酚酞试液)。同学们把三个实验的试管内所有物质都倒入一个洁净的烧杯中得到蓝色澄清液体。根据上述现象,同学们向废液中逐滴滴加_____溶液,直至观察到_____。说明废液达到了绿色排放的要求。
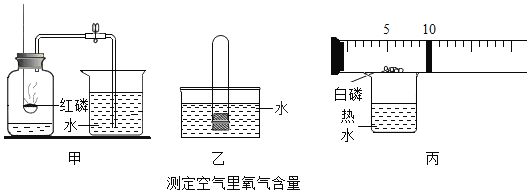
【题目】请参与下列实验探究:
(实验探究)
实验内容 | 记录数据 |
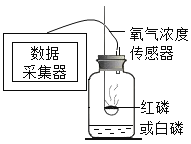
A.借助新型传感设备探究红磷、白磷在空气中燃烧时的耗氧情况
| 燃烧红磷:瓶内剩余氧气的体积分数为8.85% 燃烧白磷:瓶内剩余氧气的体积分数为3.21% |
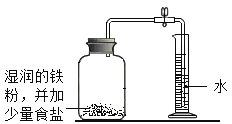
B.用铁生锈原理测定空气中氧气的体积分数
| 反应前测定:广囗瓶容积(扣除药品、导管和瓶塞所占容积)为125.0mL 反应后测定:进入广口瓶中水的体积 为25.0mL |
(1)红磷和白磷是由相同的磷元素组成的不同___(填“化合物”或“单质”)。进行A实验时,燃烧反应的化学方程式可表示为___。
(2)实验A的测定结果是在操作无误、装置不漏气,红磷、白磷均足量的情况下得到的,请从燃烧条件的角度说明红磷、白磷耗氧差异较大的主要原因___。
(3)实验B中,下列属于为加快实验进程而采取的措施是___和___(填数字编号)。
①在集气瓶中进行 ②塞紧瓶塞不漏气③使用铁粉而不使用铁丝④加少量食盐
(4)铁生锈的实质是铁与___(写化学式)发生了化学反应。根据表中记录数据,可计算出空气中氧气的体积分数为___。
(反思与拓展)铜在潮湿的空气中生成铜绿(化学式为Cu2(OH)2CO3)时也能耗氧,从化学式可以看出,铜绿的生成是铜与水及空气中的___发生反应的过程,所以,实验B___(填“能”或“不能”)用铜粉代替铁粉。