题目内容
【题目】我国每年报废的手机超过1亿部。废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。化学兴趣小组为回收其中的铜,设计并进行了如图实验。已知:Cu+H2O2+H2SO4=CuSO4+2H2O;不考虑金、银发生类似反应。
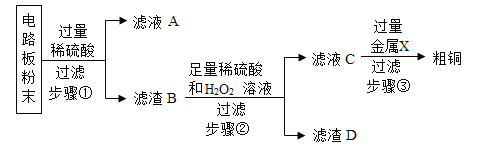
(1)将电路板粉碎成粉末的目的是_____。
(2)写出一个步骤①中发生反应的化学方程式_____。
(3)滤液A中的阳离子有_____。
(4)步骤②的目的是_____。
(5)要除去粗铜中的杂质,不能选用_____。(选填字母序号)
A 氯化铜溶液 B 稀盐酸 C 蒸馏水
【答案】增大接触面积,使反应充分,加快反应速率 Fe+H2SO4=FeSO4+H2↑ Al3+、Fe2+、H+ 将铜单质全部转化为Cu2+ C
【解析】
(1)将电路板粉碎成粉末的目的是增大接触面积,使反应充分,加快反应速率。
(2)金属活动性顺序中,氢前的金属能与稀硫酸反应,铝、铁、铜、银、金中的铝、铁可与稀硫酸反应,2Al+3H2SO4=Al2(SO4)3+3H2↑或Fe+H2SO4=FeSO4+H2↑。
(3)铝、铁、铜、银、金中的铝、铁可与稀硫酸反应,生成Al3+、Fe2+,因为加入过量的稀硫酸,所以第一次过滤后的滤液中的阳离子有Al3+、Fe2+、H+。
(4)因为Cu+H2O2+H2SO4=CuSO4+2H2O,所以步骤②的目的是将铜单质全部转化为Cu2+。
(5)步骤③的滤液中含有H2SO4、CuSO4,加入过量的铁粉,Fe+H2SO4=FeSO4+H2↑、Fe+CuSO4=Cu+FeSO4 ,所以粗铜中的杂质是铁。A 氯化铜溶液能将铁除去,Fe+CuCl2 = Cu+FeCl2,此选项不符合题意;B 稀盐酸能将铁除去,Fe+2HCl=FeCl2+H2↑,此选项不符合题意;C 铁不溶于蒸馏水,也不与蒸馏水反应,此选项符合题意。故选C。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案