【题目】在学习盐酸的化学性质时,小红、芳芳两位同学分别作了碳酸钠溶液和稀盐酸反应的实验如图所示。
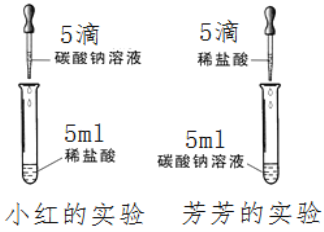
【实验现象】小红在实验中观察到有气泡冒出,而芳芳
所做的实验无现象。写出小红实验的化学反应方程式:________________。
【实验讨论】芳芳同学的试验为什么观察不到有气泡?
反应后溶液的溶质有哪些?
【查阅资料】①碳酸钠和稀盐酸反应生成物受到盐酸的质
量影响,稀盐酸过量生成二氧化碳,若盐酸量不足则生成碳酸氢钠;②碳酸氢钠与氯化钙溶液混合不发生反应,而碳酸钠和氯化钙溶液反应生成沉淀,且碳酸钠和碳酸氢钠溶液都呈碱性,氯化钙溶液呈中性。
【猜想与假设】实验反应后溶液中溶质可能有:①NaHCO3、NaCl、Na2CO3; ②NaHCO3、NaCl;
③NaHCO3、NaCl、HCl。
芳芳同学认为猜想③肯定不成立,理由是______________。
【实验设计】确定芳芳同学实验是否生成碳酸氢钠,并证明反应后的产物。
实验步骤 | 实验现象 | 实验结论 |
A、取上述溶液少量于试管中,加 入足量的________溶液。 | 产生白色沉淀 | 猜想①正确 |
B、取步骤A所得上层清液少量,滴加_______溶液。 | ___________ |
【实验反思】若用少量的稀盐酸鉴定氢氧化钠是否变质,发现无气泡冒出,则证明氢氧化钠溶液没有变质。对此实验结论,你是否赞同?若不赞同,还需说明理由。_____________。
【题目】市场上出售一种洗涤剂(标签如图),能瞬间清除衣服上汗渍、果汁渍等多种顽固污渍。某探究小组带着浓厚兴趣对这种洗涤剂的去污原理进行探究。

(査阅资料)
①过氧碳酸钠(Na2CO4)是白色晶体颗粒,常温下性质稳定,温度高于50℃时会分解,溶于水得到的溶液显碱性,与水反应会产生碳酸钠及其他化合物。
②碳酸钠具有去污能力,但不能清除衣物上的顽固污渍。
实验一:“溶解”样品
取适量该洗涤剂样品于锥形瓶中,加入适量蒸馏水,塞上带导管的橡皮塞,充分振荡,有气泡冒出,最终形成无色溶液a。将产生的气体通入石灰水,不变浑浊,打开橡皮塞,____(填操作),出现________现象,说明资料①中的“其他化合物”会产生氧气。
(提出问题)过氧碳酸钠与水反应产生的“其它化合物”是什么?
(猜想假设)
猜想1:H2O2
猜想2:NaOH
猜想3:H2O2、NaOH
实验二:验证产物
序号 | 实验操作 | 实验现象 | 分析与结论 |
(1) | 取适量溶液 a 于烧杯中,迅速加入稍过量的硝酸钡溶液,静置得清液 b。 | 产生白色沉淀 | 加入稍过量硝酸钡溶液,目的除去溶液中的碳酸钠。反应方程式为________。 |
(2) | 取少量清液 b 于试管中,加入少量二氧化锰。 | ________ | 反应的化学方程式是:____,证明过氧碳酸钠与水反应有H2O2 产生。 |
(3) | 再取少量清液 b 于试管中,滴加 2 ~3 滴氯化镁溶液。 | 无明显现象 | ________ |
(4) | 往含有酚酞的少量氢氧化钠稀溶液中,滴入 2 ~3 滴清液b。 | 有气泡产生, ________ | 过氧化氢在强碱性条件下易分解,且具有漂白性。 |
(实验结论)猜想________正确,写出过氧碳酸钠与水反应的化学方程式________。
(反思评价)该洗涤剂应________保存。