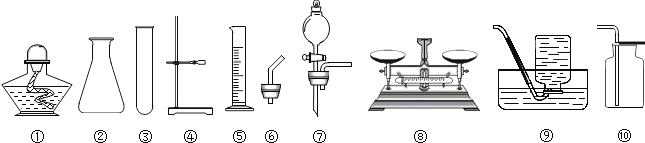
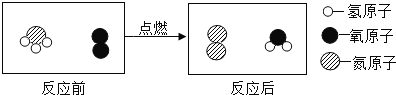
题目内容
【题目】孔雀石主要成分为Cu2(OH)2CO3(难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。工业上以孔雀石为原料制取铜的部分工艺流程如下图。
查阅资料:Fe2(SO4)3+Fe=3FeSO4

仔细分析流程,请回答:
(1)固体b的化学式为________。
(2)溶液c中阳离子有________(写离子符号)。
(3)操作一、二、三均为________(填操作名称)。
(4)在气体a生成CaCO3的过程中,发生反应:CO2+CaCl2+2NH3+H2O=CaCO3↓+2X,X的化学式为______;Fe2O3与稀硫酸反应的化学方程式为________。
(5)若所得溶液C的质量为240t,测定出溶液C中硫酸铜的质量分数为10%,请计算固体d中铜的质量_______(写出计算过程)。
【答案】SiO2 H+Cu2+Fe3+ 过滤 NH4Cl Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 9.6t
【解析】
(1)由于孔雀石主要成分为Cu2(OH)2CO3(难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质,所以固体b的化学式为 SiO2。
(2)由于孔雀石主要成分为Cu2(OH)2CO3(难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质,与过量的硫酸反应,所以溶液c含有生成的硫酸铜、硫酸铁以及剩余的硫酸,所以其中阳离子符号为 H+、Cu2+、Fe3+。
(3)操作一、二、三均为实现了固体和液体的分离,均为过滤。
(4)在气体a生成CaCO3的过程中,发生反应:CO2+CaCl2+2NH3+H2O=CaCO3↓+2X,反应前:碳原子1个,氧原子3个,钙原子1个,氯原子2个,氮原子2个,氢原子8个;反应后现有:钙原子1个,碳原子1个,氧原子3个。缺少:氮原子2个,氢原子8个,氯原子2个,分布在两个X的分子中。每个X分子含有氮原子1个,氢原子4个,氯原子1个,所以X的化学式为 NH4Cl;Fe2O3与稀硫酸反应生成硫酸铁和水,对应的化学方程式为 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
(5)若所得溶液C的质量为240t,测定出溶液C中硫酸铜的质量分数为10%,则硫酸铜的质量为240t×10%=24t
设固体d中铜的质量为x,
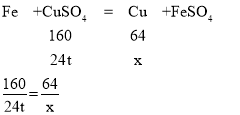
x=9.6t。
故答案为:
(1)SiO2。
(2)H+、Cu2+、Fe3+。
(3)过滤。
(4)NH4Cl; Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
(5)9.6t

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】在学习盐酸的化学性质时,小红、芳芳两位同学分别作了碳酸钠溶液和稀盐酸反应的实验如图所示。
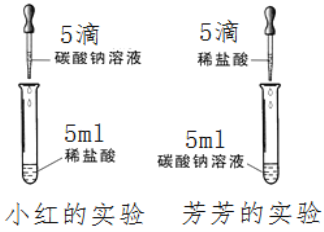
【实验现象】小红在实验中观察到有气泡冒出,而芳芳
所做的实验无现象。写出小红实验的化学反应方程式:________________。
【实验讨论】芳芳同学的试验为什么观察不到有气泡?
反应后溶液的溶质有哪些?
【查阅资料】①碳酸钠和稀盐酸反应生成物受到盐酸的质
量影响,稀盐酸过量生成二氧化碳,若盐酸量不足则生成碳酸氢钠;②碳酸氢钠与氯化钙溶液混合不发生反应,而碳酸钠和氯化钙溶液反应生成沉淀,且碳酸钠和碳酸氢钠溶液都呈碱性,氯化钙溶液呈中性。
【猜想与假设】实验反应后溶液中溶质可能有:①NaHCO3、NaCl、Na2CO3; ②NaHCO3、NaCl;
③NaHCO3、NaCl、HCl。
芳芳同学认为猜想③肯定不成立,理由是______________。
【实验设计】确定芳芳同学实验是否生成碳酸氢钠,并证明反应后的产物。
实验步骤 | 实验现象 | 实验结论 |
A、取上述溶液少量于试管中,加 入足量的________溶液。 | 产生白色沉淀 | 猜想①正确 |
B、取步骤A所得上层清液少量,滴加_______溶液。 | ___________ |
【实验反思】若用少量的稀盐酸鉴定氢氧化钠是否变质,发现无气泡冒出,则证明氢氧化钠溶液没有变质。对此实验结论,你是否赞同?若不赞同,还需说明理由。_____________。
【题目】下列实验设计不能达到目的的是( )
选项 | A | B | C | D |
实验设计 |
|
|
|
|
实验 目的 | 证明二氧化碳能溶于水 | 证明二氧化碳密度大于空气 | 证明通入的气体 是二氧化碳 | 证明小苏打能与稀盐酸反应放出 CO2 |
A. AB. BC. CD. D
【题目】为探究CO2与NaOH溶液发生的反应,某兴趣小组尝试用不同的方式进行实验。
(查阅资料)
Ⅰ.20℃时,几种物质在水中的溶解度见下表:
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 |
溶解度/g | 21.5 | 9.6 | 0.165 | 3.89 |
Ⅱ.本实验条件下,Na2CO3溶液和NaHCO3溶液的pH分别约为11.0和8.5。
(实验探究)
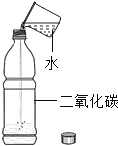
(1)实验一:小雨取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪,小雨另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是_________________________________,实验中,小雨采用两只矿泉水瓶做对比实验的目的是_________________________________。
(2)实验二:为检验CO2与NaOH溶液反应的产物,小亮取实验一所得溶液X少许,向其中滴加BaCl2溶液,有白色沉淀产生,该反应的化学方程式为_____________________________,实验中不宜将BaCl2溶液换成CaCl2溶液的原因是_____________________________________。
(3)实验三:小华取实验一所得溶液X少许,向其中加入过量的BaCl2溶液,振荡,静置,取上层清液,滴入1滴酚酞试液,发现溶液呈____色,证明溶液X中有NaOH剩余。实验中,小华没有直接向少量溶液X中滴入酚酞试液,理由是___________________________________。
(4)实验四:兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液的pH和温度变化,结果如图1、图2所示。
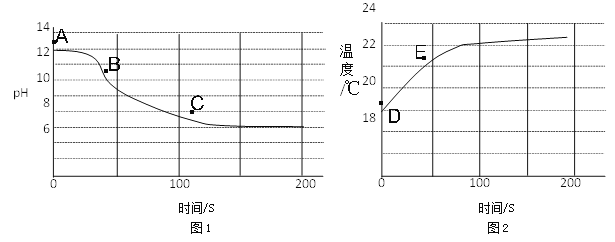
图1中,BC段发生反应的化学方程式为____________________________________。
图2中,DE段温度变化的原因是__________________________________________。
(反思感悟)
(5)实验从CO2减少、NaOH减少,Na2CO3生成等物质的变化,以及___________转化等视角多维度探究CO2与NaOH发生了反应,对于现象不明显的化学反应,可以通过现代技术手段进行数据测定,实现反应过程的“可视化”。