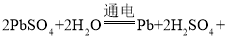题目内容
【题目】如图所示,现有甲、乙、丙、X、Y、Z六种物质,其中连线两端的甲、乙、丙溶液两两之间能发生反应;X、Y、Z之间只通过一步反应就能实现如箭头所指方向的转化。
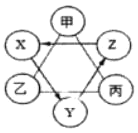
(1)若Y为黑色固体氧化物,Z为蓝色溶液,则Y为_____ (填物质名称),X生成Y的基本反应类型是_____。
(2)若甲为胃酸的主要成分,乙为一种常见的碱:则乙与丙反应的化学方程式可能为_____。
(3)若X、Y、Z为三种常见物质,且含有相同的金属元素,分别属于金属氧化物、碱、盐,则物质Z的一种用途是_____。
【答案】氧化铜 化合反应 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 建筑材料
【解析】
根据甲、乙、丙、X、Y、Z六种物质,其中连线两端的甲、乙、丙溶液两两之间能发生反应,Y是黑色氧化物,且能得到蓝色溶液,所以Y是氧化铜;甲为胃酸的主要成分,所以甲是盐酸,乙可改;X、Y、Z为三种常见物质,且含有相同的金属元素,分别属于金属氧化物、碱、盐,所以X是氧化钙,Y是氢氧化钙,Z是碳酸钙.
(1)Y为黑色固体氧化物,Z为蓝色溶液,所以Y是氧化铜,Z是铜盐溶液,可以是硫酸铜溶液,硫酸铜溶液生成X,X能生成氧化铜,所以X是铜,需要通过化合反应生成氧化铜;
(2)甲为胃酸的主要成分,所以甲是盐酸,乙为一种常见的碱,所以乙可以是氢氧化钙,丙能与盐酸和氢氧化钙反应,所以丙是碳酸钠(或碳酸钾),碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)X、Y、Z为三种常见物质,且含有相同的金属元素,分别属于金属氧化物、碱、盐,所以X是氧化钙,氧化钙能生成氢氧化钙,所以Y是氢氧化钙,氢氧化钙能生成碳酸钙,所以Z是碳酸钙,常用作建筑材料,氢氧化钙能与二氧化碳反应生成碳酸钙沉淀和水,所以物质Z的一种用途是建筑材料。
故答案为:(1)氧化铜,化合反应;(2)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;(3)建筑材料。

 目标测试系列答案
目标测试系列答案【题目】市场上出售一种洗涤剂(标签如图),能瞬间清除衣服上汗渍、果汁渍等多种顽固污渍。某探究小组带着浓厚兴趣对这种洗涤剂的去污原理进行探究。

(査阅资料)
①过氧碳酸钠(Na2CO4)是白色晶体颗粒,常温下性质稳定,温度高于50℃时会分解,溶于水得到的溶液显碱性,与水反应会产生碳酸钠及其他化合物。
②碳酸钠具有去污能力,但不能清除衣物上的顽固污渍。
实验一:“溶解”样品
取适量该洗涤剂样品于锥形瓶中,加入适量蒸馏水,塞上带导管的橡皮塞,充分振荡,有气泡冒出,最终形成无色溶液a。将产生的气体通入石灰水,不变浑浊,打开橡皮塞,____(填操作),出现________现象,说明资料①中的“其他化合物”会产生氧气。
(提出问题)过氧碳酸钠与水反应产生的“其它化合物”是什么?
(猜想假设)
猜想1:H2O2
猜想2:NaOH
猜想3:H2O2、NaOH
实验二:验证产物
序号 | 实验操作 | 实验现象 | 分析与结论 |
(1) | 取适量溶液 a 于烧杯中,迅速加入稍过量的硝酸钡溶液,静置得清液 b。 | 产生白色沉淀 | 加入稍过量硝酸钡溶液,目的除去溶液中的碳酸钠。反应方程式为________。 |
(2) | 取少量清液 b 于试管中,加入少量二氧化锰。 | ________ | 反应的化学方程式是:____,证明过氧碳酸钠与水反应有H2O2 产生。 |
(3) | 再取少量清液 b 于试管中,滴加 2 ~3 滴氯化镁溶液。 | 无明显现象 | ________ |
(4) | 往含有酚酞的少量氢氧化钠稀溶液中,滴入 2 ~3 滴清液b。 | 有气泡产生, ________ | 过氧化氢在强碱性条件下易分解,且具有漂白性。 |
(实验结论)猜想________正确,写出过氧碳酸钠与水反应的化学方程式________。
(反思评价)该洗涤剂应________保存。
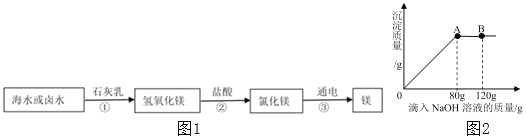
【题目】某样品仅含NaCl和MgCl2,为探究样品中MgCl2的质量分数,某研究性小组取了19g样品,加入138.8g水使其完全溶解后,再将120g一定溶质质量分数的NaOH溶液不断加入到该溶液中,充分反应后,测得相关数据如表
实验次数 | 1 | 2 | 3 | 4 |
加入NaOH溶液质量/g | 30 | 30 | 30 | 30 |
共生成沉淀的质量/g | 2.9 | 5.8 | m | 5.8 |
求:(1)表中m的值为_____(填字母)
A 大于5.8 B 小于5.8 C 等于5.8 D 大于或等于5.8
(2)样品中MgCl2的质量。_____(写出计算过程)
(3)第二次实验后溶液中溶质的质量分数为_____(保留一位小数)。
【题目】绿色骑行成为新的生活方式。下是两款自行车图。回答下列问题:
|
|
铝合金自行车 | 全塑料自行车 |
(1)材质采用铝合金的自行车,主要优点是_____________________________;自行车链条涂抹润滑油,既减小阻力,又可防止生锈,其防锈原理是_________________; 手柄的塑料是热塑性塑料,____________(填“不能”或“能”)进行热修补。
(2)开发全塑料自行车的目的是_____。