【题目】某研究性学习小组将铁粉投入盛有硫酸铜溶液的试管中,发现生成红色固体物质的同时有较多的气泡放出。这一现象激发起同学们的探究欲望,生成的是什么气体?
(提出猜想)从物质组成元素的角度,放出的气体可能是SO2、O2、H2。
(查阅资料)SO2易溶于水,能与NaOH反应,生成Na2SO3。
(方案设计)依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是_____。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。
(3)实验小组同学合作设计了如图1实验方案,对提出的猜想进行验证。
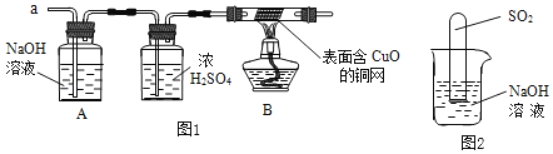
①如果放出的是O2和H2,你认为方案中的安全隐患是_____。
②丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指堵住试管口,_____,若不发出尖锐的爆鸣声,方可采用上面的装置进行实验。
(实验探究)经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减。
(实验结论)铁粉与硫酸铜溶液反应时,产生的气体是_____。
(思维拓展)
(4)由上述实验可以推出,硫酸铜溶液中可能含有_____物质(填酸性、中性或碱性)。
(5)写出装置B中所发生反应的方程式
(6)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?
丁同学设计了如图2所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论。其他同学认为这一方案不严谨,理由是_____。
(定量探究)该研究性学习小组的同学在教师的指导下,设计如下实验方案对硫酸铜溶液进行定量探究。
A.量取100mL上述硫酸铜溶液,倒入放在电子天平上的烧杯中,然后加入20.00g铁粉,充分搅拌,有关实验数据记录如下:
称量项目 | 称量时间 | 质量/g |
烧杯 | 55.65 | |
烧杯+硫酸铜溶液 | 215.65 | |
烧杯+硫酸铜溶液+铁粉 | 30s | 235.59 |
烧杯+硫酸铜溶液+铁粉 | 60s | 235.45 |
烧杯+硫酸铜溶液+铁粉 | 90s | 235.45 |
B.90s后,将烧杯中的物质经“过滤,洗涤、干燥、称量”,得滤渣15.2g。
C.取少量滤渣于试管中,加入稀硫酸,观察到有气泡产生。
(7)请根据实验现象和有关数据,回答下列问题:
①加入铁粉后,用玻璃棒不断搅拌的原因是_____。
②计算上述硫酸铜溶液中CuSO4的质量分数_____。(写出计算过程。)
【题目】碳酸钡广泛应用于显像管(CRT)、陶瓷、光学玻璃等行业。从碳酸盐矿石(主要成分是BaCO3和CaCO3)制备BaCO3的流程如下:
(已知:钡元素化合物的化学性质与钙元素化合物的化学性质相近)

请回答下列问题:
(1)步骤①中产生的气体是_____;步骤③所用的玻璃仪器有玻璃棒、_____、烧杯。
(2)已知不同温度下Ca(OH)2和Ba(OH)2的溶解度如下表:
温度(℃) | 0 | 20 | 25 | 60 |
Ba(OH)2溶解度/g | 1.67 | 3.89 | 5.60 | 20.94 |
Ca(OH)2溶解度/g | 0.189 | 0.173 | 0.148 | 0.121 |
步骤③加热悬浊液,趁热过滤的原因是_____;
(3)现在25℃时,将10g氢氧化钡放入50g水中,充分搅拌,所得溶液的溶质质量分数为_____(结果保留一位小数)。
(4)绿色化学又称环境友好化学,其核心是利用化学原理来减少和消除工业生产对环境的影响。上述流程中体现绿色化学理念的是:_____。
【题目】化学就在我们身边,请用所学的化学知识填空。
(1)写出下列物质的化学式:
①汽水中的气体_____; ②食醋中的酸_____; ③炉具清洁剂中的碱_____。
(2)无土栽培是利用营养液栽培作物的一种方法。以下是栽培绿叶菜营养液配方。
肥料成分 | 硝酸钙 | 硝酸钾 | 磷酸二氢钠 | 硫酸镁 | 硫酸铵 |
用量(毫克/升) | 1260 | 255 | 350 | 537 | 235 |
①该营养液中存在的铵根离子的符号_____。
②某硫酸铵溶液pH=4.5,则硫酸铵溶液显_____(填“酸性”、“碱性”或“中性”)。
③已知钠离子的结构示意图为 ![]() ,则钠原子最外层电子数为_____。
,则钠原子最外层电子数为_____。
④写出一个生成硝酸钾的中和反应_____。
⑤若在实验里配制10升该营养液,需要称取的硫酸镁的质量是_____毫克。
【题目】小明参观某养鱼池时,好奇的发现农民向养鱼池中撒一种淡黄色固体——过氧化钙,用来增加鱼池中的含氧量。
小明刚学完氧气的实验室制法,于是他想可否用过氧化钙制取氧气。
(提出问题)过氧化钙可否用于制取氧气?
(查阅资料)部分内容如下:过氧化钙(CaO2)室温下稳定,在300℃时分解生成氧气,主要用途可做增氧剂、杀菌剂等。
(猜想与验证)
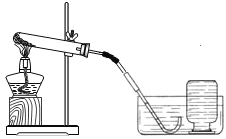
(1)小明依据资料显示:加热过氧化钙可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。操作如下:先将导管伸入液面下,用手紧握试管,观察到________,松开手后,导管口有液面上升。 |
实验结论:加热过氧化钙可制取氧气。
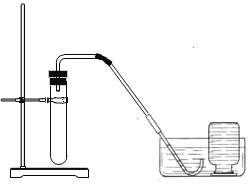
(2)小明联想到农民用过氧化钙增加鱼池中的含氧量,提出猜想Ⅱ.
猜想Ⅱ:过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 |
实验结论:不能用过氧化钙与水反应制取氧气。
分析与反思:
虽然没有快速收集到大量氧气,但由此实验现象,小明推导出农民用过氧化钙做增氧剂的主要原因是 。
(3)小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?
你的合理建议: 。
这些建议是否可行,还需进一步通过实验验证。