【题目】现有H2SO4和CuSO4的混合溶液,为了测定CuSO4的质量分数,小明同学进行如下实验:
取混合溶液于烧杯中,向其中加入铁片至完全反应。反应前后,有关数据如表。
烧杯 | 原混合溶液 | 加入的铁片 | 反应后烧和烧杯内物质的总质量(克) | 剩余铁片 | 析出铜 | |
质量(克) | 80 | 100 | 20 | 199.8 | 3.2 | 12.8 |
(1)实验中产生氢气的质量为______克。
(2)请根据实验数据计算原混合溶液中CuSO4的质量分数______。
(3)小红同学用加入足量BaCl2溶液,通过生成BaSO4沉淀的质量来计算原混合溶液中CuSO4的质量分数,请分析是否合理并说明原因______。
【题目】日常生活中使用的塑料袋有用聚乙烯制成的,也有用聚氯乙烯制成的。小明同学听说包装食品的塑料袋应该是前者而不是后者,便设计了一个实验方案,用平常在超市买东西时带回来的塑料袋进行探究,以验证其成分。
查阅资料:聚乙烯燃烧生成CO2和H2O;聚氯乙烯燃烧除了生成CO2和H2O之外,还会有HCl气体产生。
实验探究:小明将以下实验装置按ABCD顺序连接好,然后进行探究。
(1)在实验过程中若B、C、D装置都产生明显的现象,则该塑料袋是用______制成的。(填“聚氯乙烯”或“聚乙烯”)
实验反思:连接实验装置时,能否将装置C、D顺序调换?请简述。
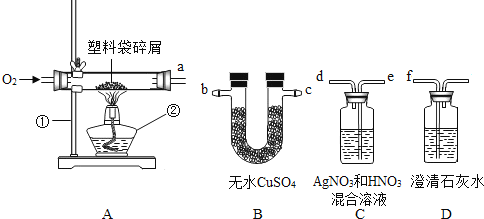
答:______理由是______
继续探究:小明为了测定聚乙烯的组成,取了5.6g聚乙烯塑料碎片放在硬质玻璃管中,鼓入充足的氧气使之燃烧,将产生的气体通入足量的浓硫酸和氢氧化钠溶液中,并将实验结果记录在下表中。实验结果:
实验前 | 实验后 | |
B装置的质量/g | 213.6 | 220.8 |
C装置的质量/g | 200.2 | 217.8 |
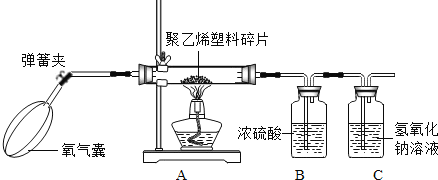
(2)根据实验结果可以判断:聚乙烯燃烧生成的水的质量是______;二氧化碳的质量是______。
(3)聚乙烯中是否含有氧元素______(填“有”或“无”);碳氢元素的质量比为______。
【题目】某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
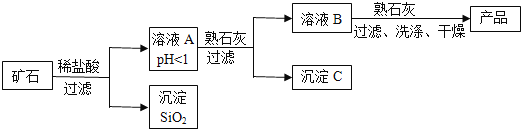
请回答下列问题:
(1)溶液A中共含有______种阳离子;写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式______(只写一个)
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀,该实验条件下,使金属阳离子沉淀的相关pH数据见表。为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可允许的范围为是______;
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
(3)写出溶液B中加入熟石灰发生的化学反应方程式______。






