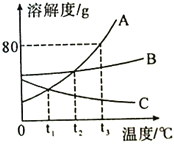
题目内容
【题目】为研究氢氧化钠、氢氧化钙两种溶液的化学性质,进行如下实验。

①A、D中酚酞均变_____色,说明两种溶液都呈碱性。
②B中溶液的pH_____7(选填“>”、“<”或“=”)。写出氢氧化钠与盐酸反应的化学方程式________________________。
③F中沉淀的化学式是______________。
④四支试管内的物质在G中混合后得到无色溶液,其中一定含有的溶质是____________,可能含有的溶质是___________________。
【答案】 红 < NaOH+HCl=NaCl+H2O CaCO3 NaCl、KCl CaCl2; HCl
【解析】试题分析:①酚酞溶液遇碱性溶液变为红色 ②因为B中含有盐酸,盐酸显酸性,故溶液的pH<7 ,酸碱反应生成盐和水, ③因为K2CO3+ Ca(OH)2= CaCO3↓ + 2KOH,故沉淀是CaCO3 ④因为反应有NaOH+HCl=NaCl+H2O ,K2CO3+ Ca(OH)2= CaCO3↓ + 2KOH ,生成的KOH与过量的盐酸反应:KOH+HCl=" KCl" + H2O ,2HCl+ Ca(OH)2= CaCl2+2H2O,故G中混合后得到无色溶液中一定含有的溶质是NaCl、KCl CaCl2 ,可能盐酸过量,故可能含有的溶质是HCl

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目