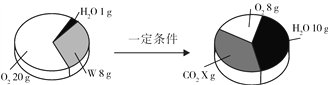
【题目】为了探究金属活动性,将锌和铜分别放入稀硫酸中,铜不反应而锌的表面有气泡产生,写出锌和稀硫酸反应的化学方程式:______。
老师告诉学生,铜和浓硫酸在加热的条件下也能反应且产生气体。
(提出问题)铜与浓硫酸反应的生成物是什么?其中气体是什么?
猜想假设)同学们对产生的气体作出了猜想。
猜想一:氢气;猜想二:二氧化硫;猜想三:氢气和二氧化硫的混合物。
(查阅资料)二氧化硫可以使品红溶液褪色,也能被氢氧化钾溶液吸收。浓硫酸只吸收水。
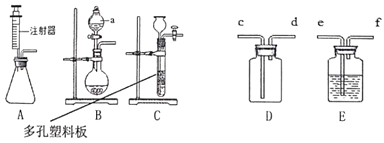
(实验探究)师生设计了如下装置进行实验![]() 部分仪器省略
部分仪器省略![]() ,请完成下列表格。
,请完成下列表格。

主要实验步骤 | 主要现象 | 解释或结论 |
①加热装置A一段时间 | 装置B中的现象是 ______ | 有二氧化硫生成 |
②点燃装置D处酒精灯 | 装置D玻璃管中无明显现象 | 猜想 ______ 正确 |
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气 | | |
④冷却,将A中液体用水稀释 | A中液体变为 ______ 色 | 有硫酸铜生成 |
(表达交流)(1)在步骤③中,鼓入空气的目的是______。
(反思拓展)(2)若将装置A中铜丝换成锌片,随着反应的进行,硫酸的浓度逐渐变小,装置D玻璃管中看到的现象是______,C装置的作用是:______。
(3)下列各组药品能够证明锌的活动性比铜强的是______![]() 填序号
填序号![]() 。
。
①锌、铜、稀盐酸
②锌、硫酸铜溶液
③锌、铜、氯化镁溶液
(1)加热A装置一段时间后,气泡产生的速率由快变慢最后不再产生,请对这一现象进行解释:______。
(2)请尝试写出铜与浓硫酸反应的化学方程式:______。
【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物进行系列实验。
(査阅资料)碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:![]() 。
。
(进行实验)实验1:取质量比1:11的木炭粉和氧化铜混合物![]() ,进行实验。
,进行实验。
序号 | | |
装置 |
|
|
反应后物质的 颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1-2装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
| 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
| 1:10 | 混有很少量黑色物质 | |
| 1:11 | 混有极少量黑色物质 | |
| 1:12 | 无黑色物质 | |
| 1:13 | 混有较多黑色物质 | |
(1)实验![]() 中,证明产生了
中,证明产生了![]() 的现象是______。
的现象是______。
(2)实验![]() 比
比![]() 更好的原因是______。
更好的原因是______。
(3)实验2的结论是______。
(反思与评价)
(4)实验2没有进行质量比为1:14的实验,理由是______。
(5)为检验![]() 的红色固体中是否
的红色固体中是否![]() 请你设计实验方案三
请你设计实验方案三![]() 方法、现象及结论
方法、现象及结论![]()
方法:______。可能的现象及结论______。