题目内容
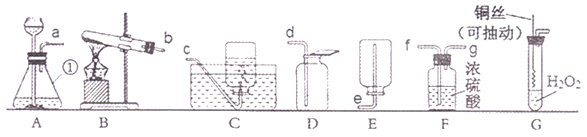
【题目】下图是实验室制取并收集气体的常见装置。
(1)图中a的仪器名称是______,实验室用石灰石与稀盐酸制取二氧化碳的化学方程式:______。
(2)若用C装置制取二氧化碳,其优点是:______。若用A装置作为发生装置,如何检查装置气密性:(可以添加需要的仪器)______。
(3)若用D装置收集氢气,则气体从______(填字母,下同)进入。若用E装置收集,则气体从______进入。
【答案】分液漏斗 ![]() 便于控制反应的开始与停止 在导管口处连接乳胶管并用弹簧夹夹紧,拉动注射器活塞,松手后活塞回到初始位置 d f
便于控制反应的开始与停止 在导管口处连接乳胶管并用弹簧夹夹紧,拉动注射器活塞,松手后活塞回到初始位置 d f
【解析】
(1)仪器a是分液漏斗;石灰石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)在装置C中,固体药品放在多孔隔板上,液体药品从长颈漏斗中加入。反应开始后,关闭开关,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止;打开开关,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行。装置C制取二氧化碳的优点是可以控制反应的开始与停止;若用A装置作为发生装置,检查A装置气密性的方法是在导管口处连接乳胶管并用弹簧夹夹紧,拉动注射器活塞,松手后活塞回到初始位置,说明装置A的气密性是良好的;
(3)氢气的密度比空气小,若用装置D收集氢气时,氢气从d(短)管进入;氢气的密度比水小,若用装置E收集氢气时,氢气应从f(短)管进入。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表中某一周期元素的原子结构示意图。请回答下列问题:
元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
原子结构示意图 |
|
|
|
|
|
|
|
|
(1)表中磷原子的核电荷数x=_________
(2)表中具有相对稳定结构的元素是_________
(3)在化学反应中,每个铝原子失去_________个电子形成铝离子
(4)镁元素与氯元素形成的化合物化学式为_________
【题目】酸和碱能发生中和反应,它在日常生活和工农业生产中有着广泛的应用。下图表示硫酸和氢氧化钠溶液发生反应时烧杯中溶液的pH随加入液体体积的变化曲线及相关的实验操作。请从中获取信息,回答下列问题:
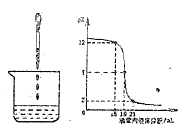
(1)烧杯中盛放的是______溶液。
(2)小明向氢氧化钠溶液中加入稀硫酸,该中和反应的实质是______。然后,对反应过程中废液的溶质进行了如下探究:
(提出问题)氢氧化钠溶液和稀硫酸混合后,溶质是什么?
(查阅资料)硫酸钠溶液呈中性
(猜想假设)猜想I硫酸钠和氢氧化钠;猜想Ⅱ硫酸钠和硫酸;猜想Ⅲ______。
(设计实验)
实验操作 | 实验现象 | 实验结论 |
①取少量废液于试管中,滴入几滴酚酞试液 | 溶液无明显变化 | 猜想______不成立 |
②另取少量废液于试管中,滴入几滴氯化钡溶液 | ______ | 猜想Ⅱ成立 |
(反思与评价)小芳认为实验操作②得出的结论不成立,理由是______。可以改为向废液中加入少量______,溶液变为红色,证明猜想Ⅱ成立
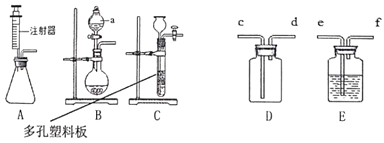
【题目】1775年法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,如今我们的化学教育家积极探索、不断创新,先后设计出了如图所示的实验装置。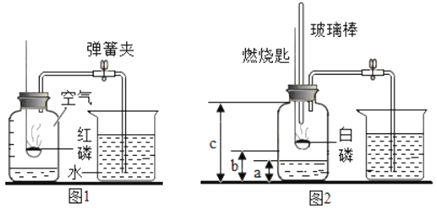
(提出问题)用红磷燃烧的方法为什么测出的氧气含量远低于21%?
(分析讨论)(1)实验装置漏气;(2)______,导致装置内氧气有剩余;(3)……
(实验改进)(1)如图2所示的实验装置进行实验探究。实验前在集气瓶里先装进a体积的水,其作用:一是为了加快集气瓶的冷却速度;二是______。
(2)如图3所示的实验装置进行实验探究。
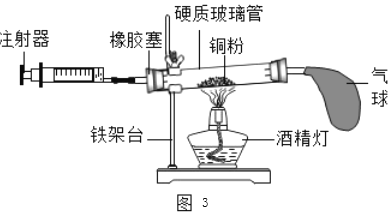
①在实验过程中,不断推拉注射器的目的是______。
②写出该实验中反应的化学方程式______。
③测得实验结果如下(气体体积):(单位:mL)
反应前玻璃管内 | 反应前注射器内 | 反应后注射器内 |
40 | 30 | 18 |
由此数据可以推算出他测定的空气中氧气的体积分数为______。
(实验结论)(1)研究空气的成分实验是在密封容器内进行。
(2)该物质在空气中可以燃烧且只与空气中的氧气反应。
(3)燃烧后的产物______。