【题目】铝是一种应用广泛的金属。某兴趣小组对金属铝展开了系列研究。
I 研究铝的化学性质
(1)铝在常温下会与氧气反应,表面形成一层致密的氧化膜,化学方程式为_________ 。 实验前,需要对铝的表面先进行______________(填操作)处理。兴趣小组同学将铝处理好后剪 成若干大小相同的小片,用于后续实验。
(2)铝和酸、碱、盐溶液的反应
实验 | 操作 | 现象 | 结论 |
一 | 将铝片放入稀 盐酸中 | ______________,试管变烫 | 铝能与盐酸发生反应,反应放热 |
二 | 将铝片放入氢 氧化钠溶液中 | 铝表面有气泡产生,试管变 烫 | 铝能与氢氧化钠溶液反应,反应 放热 |
三 | 将铝放入硫酸 铜溶液中 | 铝表面有红色物质产生,溶 液逐渐变成无色 | 金属活动性:铝_____铜 |
实验一的现象为______________________。实验二查阅资料:铝和氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为______________________。实验三表明,铝的金属活动性_____________(填“大于“或”小于“)铜。
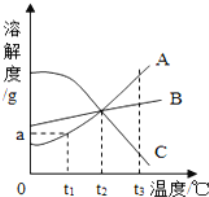
(3)小组同学将实验一中的稀盐酸换成等质量、氢离子浓度相同的稀硫酸,相同时间内 发现铝片表面产生的气泡较少,反应较慢。
对比上述两组实验产生猜想。 猜想①:稀盐酸中的氯离子对反应可能有促进作用。 猜想②:_____。
为验证猜想①是否合理,应在铝和稀硫酸中加入___________(填字母),观察现象。
A.Na2SO4 B.Na2CO3 C.NaCl
II 测定某铝样品中金属铝的质量分数
【资料1】氢氧化铝能与氢氧化钠溶液反应,但不与氨水反应。
【资料2】AlCl3+3NaOH=Al(OH)3↓+3NaCl;AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl。
(4)小组同学称取4.62g某金属铝样品(样品中杂质仅为氧化铝),置于图一烧瓶中,加入足量稀盐酸至完全反应。将反应后的液体分成溶液1和溶液2两等份,设计两种实验方案(如图三),通过沉淀质量测定样品中金属铝的质量分数。
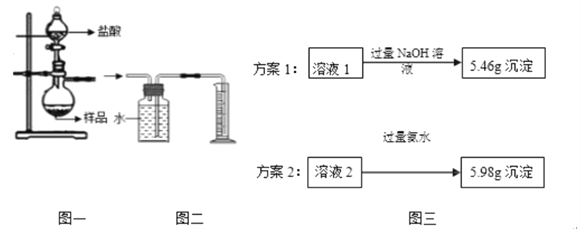
①选择正确的一种实验方案,计算样品中金属铝的质量分数(请写出计算过程).
②小组同学组合图一和图二装置测氢气体积,烧瓶中反应停止即读出量筒内水的体积, 计算后发现金属铝的质量分数偏大,可能的原因是?