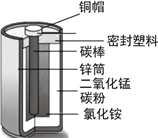
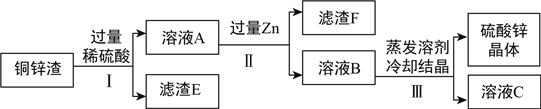
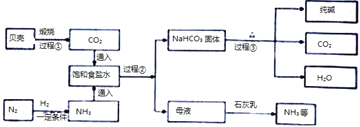
题目内容
【题目】甲、乙两固体物质溶解度曲线如图所示。下列说法正确的是

A. 甲的溶解度比乙的大
B. 若甲中混有少量乙,可采用蒸发溶剂的方法提纯
C. t1℃时,甲、乙的饱和溶液各50g,其溶质的质量相等
D. t2℃时,甲的不饱和溶液变为饱和溶液,可采用升温方法
【答案】C
【解析】A、比较物质的溶解度大小须确定温度,错误;B、甲、乙两物质的溶解度随温度的升高而增大,且甲受温度的影响较大,乙受温度的影响变化较小。若甲中混有少量乙,可采用降温结晶的方法提纯,错误;C、t1℃时,甲、乙的溶解度相等,故t1℃时,甲、乙的饱和溶液各 50g,其溶质的质量相等,正确;D、甲物质的溶解度随温度的升高而增大,t2℃时,甲的不饱和溶液变为饱和溶液,可采用降温的方法,错误。故选C。

【题目】氯化钠和硫酸镁的溶解度曲线与若干温度下的溶解度表如下:
温度/℃ | 20 | 30 | 40 | 60 | 80 | 90 | 100 | |
溶解度 (g/100GH20) | NaCl | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | 39.0 | 39.8 |
MgSO4 | 33.7 | 38.9 | 44.5 | 54.6 | 55.8 | 52.9 | 50.4 | |

请回答下列问题:
(1)80℃时,硫酸镁的溶解度为__________,溶解度曲线甲所代表的物质是__________。a点对应的温度t1范围是____________________。
(2)t2℃时有含有较多NaCl 的MgSO4溶液,为了得到纯净的MgSO4,可采用的方法__________
(3)40℃时把20g NaCl放入50g水中,形成的溶液中溶质质量分数为__________(精确到0.1%),要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是__________。
【题目】分析处理图表信息是学习的一种重要方法。下表是氯化钠和硝酸钾在不同温度下的溶解度。
温度/℃ | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 31.6 | 63.9 | 110 | 169 | |
这两种固体物质在水中的溶解度曲线如图所示:
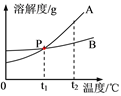
请仔细阅读图表后回答下列问题:
(1)A曲线表示的是________的溶解度曲线。(填“NaCl”或“KNO3”)
(2)P点的含义是___________________________。
(3)t2℃时,将等质量的A和B的饱和溶液降温至t1℃,所得溶液的质量大小关系是A____B。(填“<”、“>”或“=”)