【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下稀盐酸和氢氧化钙发生的中和反应实验探究。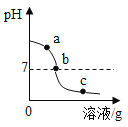
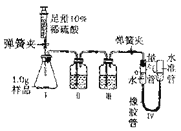
【演示实验】由图可知该实验操作是将______________滴加到另一种溶液中。该反应的化学方程式是___________________________;
【查阅资料】CaCl2溶液显中性, CaCl2+Na2CO3 =CaCO3↓+2NaCl
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2
猜想Ⅱ:有____________________
猜想Ⅲ:有CaC12和Ca(OH)2
猜想Ⅳ:有CaCl2、HC1和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是____________________________;
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊试液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
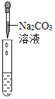
实验现象 | _______________ | ______________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【得出结论】通过探究,全班同学一致确定猜想Ⅲ是正确的。
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因_______________________________;
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑________________。
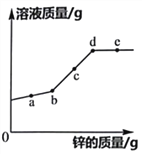
【题目】为测定某铜锌合金中锌的含量,取50g样品进行实验,将l00g稀盐酸分五次加入该样品中(杂质不溶于水也不参与反应,反应原理为:Zn+2HCl=ZnCl2+H2↑),充分反应后测得生成气体的总质量如表所示:
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 0.05 | 0.10 | m | 0.20 | 0.20 |
试求:(1)m的数值为___________。
(2)该铜锌合金中锌的质量分数是___________?(写出计算过程)
【题目】为测定某黄铜(铜、锌合金)中铜的质量分数,称取32.5g该黄铜粉末放入烧杯中,再向烧杯内加入200g稀硫酸(足量),每隔10分钟测烧杯内(不含烧杯)剩余物质的质量,测得数据如表:
加入稀硫酸后10分钟 | 加入稀硫酸后20分钟 | 加入稀硫酸后 | 加入稀硫酸后40分钟 | 加入稀硫酸后50分钟 |
232.4g | 232.3g | 232.2g | 232.1g | 232.1g |
(1)完全反应后生成氢气的质量为______g.
(2)计算该黄铜中铜的质量分数为________(写出计算过程).