4.下列化学用语表示正确的是( )
| A. | 3个水分子:3H2O | B. | 2个氮原子:N2 | C. | 硫酸铁:FeSO4 | D. | 钙离子:Ca+2 |
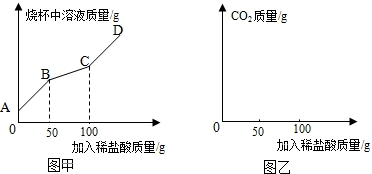
20.下列图象能正确反应其对应关系的是( )
| A. |  向一定量PH=3的盐酸溶液中不断加水稀释 | |
| B. |  温度不变时,向一定量的饱和石灰水中不断加入生石灰 | |
| C. |  向盛有相同质量的镁和氧化镁的烧杯中分别加入相同溶质质量分数的稀盐酸至过量 | |
| D. |  将一定质量的红磷放在盛有氧气的密闭容器中加热至燃烧 |
19.有X和Y两种元素,它们相互化合能形成甲、乙两种化合物,已知甲中X的质量分数为75%,乙中X元素的质量分数为80%,若甲的化学式为XY4,则乙的化学式为( )
0 166284 166292 166298 166302 166308 166310 166314 166320 166322 166328 166334 166338 166340 166344 166350 166352 166358 166362 166364 166368 166370 166374 166376 166378 166379 166380 166382 166383 166384 166386 166388 166392 166394 166398 166400 166404 166410 166412 166418 166422 166424 166428 166434 166440 166442 166448 166452 166454 166460 166464 166470 166478 211419
| A. | XY2 | B. | X2Y | C. | XY3 | D. | X2Y3 |
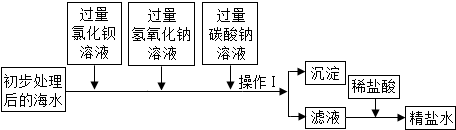
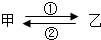 甲、乙是初中化学常见的物质,它们在一定条件下能如图所示相互转化.
甲、乙是初中化学常见的物质,它们在一定条件下能如图所示相互转化.
 某同学在学完《分子和原子》后,对教材中的实验进行了如图改进:
某同学在学完《分子和原子》后,对教材中的实验进行了如图改进: 某化学兴趣小组利用如下装置探究两个实验.
某化学兴趣小组利用如下装置探究两个实验.