10.实验室常用下列装置制取有关气体.
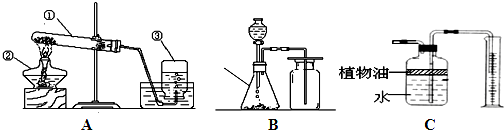
(1)用KMnO4固体来制取O2,应选用图中的A装置(填A或B).该发生装置还可以做我们学过的铜绿分解实验,用写出这个反应的文字表达式铜绿$\stackrel{加热}{→}$氧化铜+二氧化碳+水.
(2)C装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是防止二氧化碳溶于水,植物油上方原有的空气对实验的结果没有(填“有”或“没有”)明显影响.
(3)利用B\C组合装置测得反应生成气体体积偏大的最主要原因是:利用该装置测得气体体积,实际包括反应生成的气体,还有滴入锥形瓶内的液体的体积,所以,所测得结果偏大.
加热
(4)氨气(NH3)的密度比空气的小,极易溶于水,实验室制取氨气的反应原理是:氢氧化钙(固)+氯化铵(固)$\frac{\underline{\;加热\;}}{\;}$氯化钙(固)+氨气+水.实验室制取氨气,若选择A装置,应该将此装置如何改动?排水法改为向下排空气法
(5)实验室里还可采用B图装置,通过用MnO2作催化剂分解过氧化氢(H202)的方法制取氧气.写出该反应的文字表达式:过氧化氢$\stackrel{二氧化锰}{→}$水+氧气
(6)某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究.他们进行以下实验:
①往盛有5mL5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mLω%H2O2溶液的试管中,加入a克MnO2,伸入带火星的木条,木条复燃.
③往盛有5mLω%H2O2溶液的试管中,加入a克Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②,③中反应后试管中仍分别含有a克MnO2和a克Fe2O3.
【问题】(1)MnO2和Fe2O3是上述反应中的催化剂剂.
(2)实验②,③中的H2O2的浓度(ω%)以5%为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需的时间
【问题】(3)从上表中能得出哪些结论?催化剂相同时过氧化氢溶液浓度越大,反应速度越快;
(7)【提出问题】小松同学用“双氧水”(过氧化氢溶液)清洗伤口时,不小心将过氧化氢溶液滴到水泥板上,发现有大量气泡产生.小松联想到自己曾经用二氧化锰做过氧化氢分解的催化剂,他想,水泥块能否也可作过氧化氢分解的催化剂呢?于是他到附近建筑工地取回一些小水泥块,并用蒸馏水浸泡,冲洗、干燥,并进行以下探究.
【猜想】水泥块能作过氧化氢分解的催化剂.
【实验验证】
【结论】水泥块能加快过氧化氢的分解速率,故水泥起能作过氧化氢的催化剂.
【讨论与反思】小芳认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验:探究水泥块在反应前后质量是否改变.
【实验步骤】①准确称量水泥块的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,干燥,称量④对比反应前后水泥块的质量.
【分析】如果水泥块反应前后质量不变,则说明水泥块可以作为过氧化氢分解的催化剂.但小华认为,要证明小松的猜想,小芳的补充实验还是不足够,还需要再补充一个探究实验:探究水泥块的化学性质在反应前后是否改变.

(1)用KMnO4固体来制取O2,应选用图中的A装置(填A或B).该发生装置还可以做我们学过的铜绿分解实验,用写出这个反应的文字表达式铜绿$\stackrel{加热}{→}$氧化铜+二氧化碳+水.
(2)C装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是防止二氧化碳溶于水,植物油上方原有的空气对实验的结果没有(填“有”或“没有”)明显影响.
(3)利用B\C组合装置测得反应生成气体体积偏大的最主要原因是:利用该装置测得气体体积,实际包括反应生成的气体,还有滴入锥形瓶内的液体的体积,所以,所测得结果偏大.
加热
(4)氨气(NH3)的密度比空气的小,极易溶于水,实验室制取氨气的反应原理是:氢氧化钙(固)+氯化铵(固)$\frac{\underline{\;加热\;}}{\;}$氯化钙(固)+氨气+水.实验室制取氨气,若选择A装置,应该将此装置如何改动?排水法改为向下排空气法
(5)实验室里还可采用B图装置,通过用MnO2作催化剂分解过氧化氢(H202)的方法制取氧气.写出该反应的文字表达式:过氧化氢$\stackrel{二氧化锰}{→}$水+氧气
(6)某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究.他们进行以下实验:
①往盛有5mL5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mLω%H2O2溶液的试管中,加入a克MnO2,伸入带火星的木条,木条复燃.
③往盛有5mLω%H2O2溶液的试管中,加入a克Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②,③中反应后试管中仍分别含有a克MnO2和a克Fe2O3.
【问题】(1)MnO2和Fe2O3是上述反应中的催化剂剂.
(2)实验②,③中的H2O2的浓度(ω%)以5%为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需的时间
浓度 时间(min) 条件 | 30%H2O2溶液 | 15%H2O2溶液 | 5%H2O2溶液 |
| a克MnO2 | 0.2 | 0.8 | 2.0 |
| a克Fe2O3 | 7.0 | 9.0 | 16.0 |
(7)【提出问题】小松同学用“双氧水”(过氧化氢溶液)清洗伤口时,不小心将过氧化氢溶液滴到水泥板上,发现有大量气泡产生.小松联想到自己曾经用二氧化锰做过氧化氢分解的催化剂,他想,水泥块能否也可作过氧化氢分解的催化剂呢?于是他到附近建筑工地取回一些小水泥块,并用蒸馏水浸泡,冲洗、干燥,并进行以下探究.
【猜想】水泥块能作过氧化氢分解的催化剂.
【实验验证】
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解 |
| 实验二 | 在装有过氧化氢溶液的试管中加入水泥块,然后将带火星的木条伸入试管中 | 木条复燃 | 水泥块能加快双氧水分解速率 |
【讨论与反思】小芳认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验:探究水泥块在反应前后质量是否改变.
【实验步骤】①准确称量水泥块的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,干燥,称量④对比反应前后水泥块的质量.
【分析】如果水泥块反应前后质量不变,则说明水泥块可以作为过氧化氢分解的催化剂.但小华认为,要证明小松的猜想,小芳的补充实验还是不足够,还需要再补充一个探究实验:探究水泥块的化学性质在反应前后是否改变.
9.某兴趣小组利用下列装置进行实验室制取和收集气体的实验,请回答:
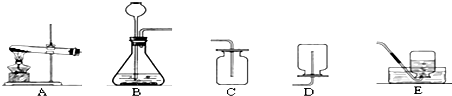
(1)若用加热高锰酸钾来制取并收集较干燥的氧气,应选用的装置组合是AC(填装置序号),在加入药品之前,应进行的操作是检查装置的气密性.
(2)若用E装置收集氧气,水槽中出现紫红色,最可能的原因是试管口没放棉花团;
(3)某同学观察到发生装置内有大量气泡时,开始用C装置收集氧气,过一段时间后用带火星的木条伸入瓶口、瓶中和瓶底,都末见木条复燃.其原因是装置气密性不好.
(4)用C装置收集气体时,在给药品加热时候开始收集气体.
(5)瑞利和拉姆塞两位科学家在利用氨氧化原理进行实验时,所需氨气的制取反应原理如下:2NH4Cl(固体)+Ca(OH)2(固)$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
已知空气、氨气在标准状况下的密度和溶解性如表:
根据上述信息,请你帮助两位科学家选择实验室制取氨气的发生装置是A,收集氨气的装置是D.(填上表装置图的编号)

(1)若用加热高锰酸钾来制取并收集较干燥的氧气,应选用的装置组合是AC(填装置序号),在加入药品之前,应进行的操作是检查装置的气密性.
(2)若用E装置收集氧气,水槽中出现紫红色,最可能的原因是试管口没放棉花团;
(3)某同学观察到发生装置内有大量气泡时,开始用C装置收集氧气,过一段时间后用带火星的木条伸入瓶口、瓶中和瓶底,都末见木条复燃.其原因是装置气密性不好.
(4)用C装置收集气体时,在给药品加热时候开始收集气体.
(5)瑞利和拉姆塞两位科学家在利用氨氧化原理进行实验时,所需氨气的制取反应原理如下:2NH4Cl(固体)+Ca(OH)2(固)$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
已知空气、氨气在标准状况下的密度和溶解性如表:
| 物质 | 空气 | 氨气 |
| 密度/(g/L) | 1.293 | 0.771 |
| 溶解性 | / | 极易溶于水 |
8.下列反应属于化合反应的是( )
| A. | 工业制氧气 | B. | 用大理石和盐酸混合制二氧化碳 | ||
| C. | 在空气中点燃红磷 | D. | 加热高锰酸钾制氧气 |
7.实验室用加热氯酸钾和二氧化锰的混合物制取氧气,下列相关装置及操作正确的是( )
| A. |  发生装置 | B. |  排水法收集氧气 | C. |  验满 | D. |  存放氧气 |
6.下列有关水的叙述不正确的是( )
| A. | 水是由氢元素和元素组成的 | |
| B. | 农业上可采用喷灌、滴灌技术,以节约用水 | |
| C. | 工业废水处理达标后再排放 | |
| D. | 在煤炉上放一盆水,可以防止煤气中毒 |
5.根据质量守恒定律,碱式碳酸铜[Cu(OH)2CO3]受热分解,不可能得到物质的是( )
| A. | CuO | B. | H2O | C. | CO2 | D. | HCl |
2.在人体中缺乏某种维生素会使人患病.夜盲症患者缺乏( )
| A. | 维生素C | B. | 维生素A | C. | 维生素B1 | D. | 维生素B12 |
1.用石蕊试液和酚酞试液分别滴入同一物质的溶液中,下列现象不可能发生的是( )
0 165225 165233 165239 165243 165249 165251 165255 165261 165263 165269 165275 165279 165281 165285 165291 165293 165299 165303 165305 165309 165311 165315 165317 165319 165320 165321 165323 165324 165325 165327 165329 165333 165335 165339 165341 165345 165351 165353 165359 165363 165365 165369 165375 165381 165383 165389 165393 165395 165401 165405 165411 165419 211419
| A. | 滴入石蕊试液变红色,滴入酚酞试液不变色 | |
| B. | 滴入石蕊试液不变色,滴入酚酞试液不变色 | |
| C. | 滴入石蕊试液变蓝色,滴入酚酞试液变红色 | |
| D. | 滴入石蕊试液变红色,滴入酚酞试液变红色 |
 医生给病人输液时,常用葡萄糖注射液.图为葡萄糖注射液的部分标签图,请根据图回答问题:
医生给病人输液时,常用葡萄糖注射液.图为葡萄糖注射液的部分标签图,请根据图回答问题: