19.某学生做了如图所示的实验.
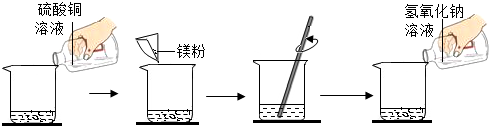
若第二次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题:
(1)写出第二次实验中发生反应的化学方程式Mg+CuSO4=Cu+MgSO4、MgSO4+2NaOH=Na2SO4+Mg(OH)2↓;
(2)第一次实验后溶液中溶质的变化情况为硫酸铜减小至消失,硫酸镁的质量先增加后减少至消失,硫酸钠的质量增加;
(3)根据已知条件列出求解第二次实验生成沉淀物质的质量(X)的比例式$\frac{24}{2.4g}$=$\frac{58}{x}$;
(4)实验中加入硫酸铜溶液的质量(m)为160g;
(5)若第二次反应后所得不饱和溶液中溶质的质量分数为5%,则向所得滤液中应加入水的质量为53.8g.

| 第一次 | 第二次 | |
| 加入l0%硫酸铜溶液的质量 | m | m |
| 加入镁粉的质量 | 1.2g | 2.4g |
| 加入氢氧化钠溶液质量 | 80g | 80g |
(1)写出第二次实验中发生反应的化学方程式Mg+CuSO4=Cu+MgSO4、MgSO4+2NaOH=Na2SO4+Mg(OH)2↓;
(2)第一次实验后溶液中溶质的变化情况为硫酸铜减小至消失,硫酸镁的质量先增加后减少至消失,硫酸钠的质量增加;
(3)根据已知条件列出求解第二次实验生成沉淀物质的质量(X)的比例式$\frac{24}{2.4g}$=$\frac{58}{x}$;
(4)实验中加入硫酸铜溶液的质量(m)为160g;
(5)若第二次反应后所得不饱和溶液中溶质的质量分数为5%,则向所得滤液中应加入水的质量为53.8g.
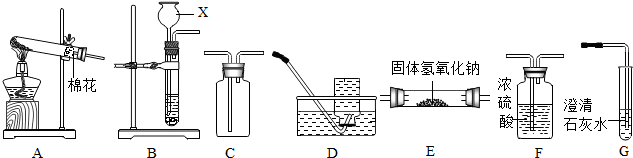
15.今年中考化学技能考试中,小林抽到的考题是:用碳酸钠溶液来鉴别稀盐酸、食盐水和澄清石灰水.小林同学按以下过程进行作答:
【进行实验】
写出试管C中反应方程式Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
【发现问题】如何处理上述废液才能减少对环境的污染?
【思考与分析】应先对废液中的溶质成分进行探究,后制定方案.
【实验与探究】
(1)小林将所有废液倒入一洁净烧杯中,静置后得到上层清液.
(2)取少量清液加入适量的氯化钙溶液(中性),再滴加几滴无色酚酞试液,若出现有白色沉淀且酚酞变红的现象,说明上层清液中一定有碳酸钠和氢氧化钠,一定没有Ca(OH)2、HCl.(填化学式)
【方法与应用】通过以上探究,处理上述废液的正确方法是:在废液中继续加入盐酸,调节溶液pH=7,蒸发获得氯化钠晶体.
【进行实验】
| 操作步骤 | 实验现象 | 实验结论 |
| 分别用A、B、C三支试管取样,然后各加入适量碳酸钠溶液 | A中无明显现象 B中有气体 C中有白色沉淀 | A中物质是食盐水 B中物质是稀盐酸 C中物质是澄清石灰水 |
【发现问题】如何处理上述废液才能减少对环境的污染?
【思考与分析】应先对废液中的溶质成分进行探究,后制定方案.
【实验与探究】
(1)小林将所有废液倒入一洁净烧杯中,静置后得到上层清液.
(2)取少量清液加入适量的氯化钙溶液(中性),再滴加几滴无色酚酞试液,若出现有白色沉淀且酚酞变红的现象,说明上层清液中一定有碳酸钠和氢氧化钠,一定没有Ca(OH)2、HCl.(填化学式)
【方法与应用】通过以上探究,处理上述废液的正确方法是:在废液中继续加入盐酸,调节溶液pH=7,蒸发获得氯化钠晶体.
14.学完纯碱的化学性质后,小红同学为探究碳酸钾的化学性质进行了如下表中的四种猜想,并设计实验进行验证.请你帮助她将下列实验报告填写完整.
【交流与反思】K2CO3溶液和Na2CO3溶液的化学性质十分相似,其主要原因是它们的溶液中都含有相同的CO32- (填离子符号).
| 猜想 | 实验操作 | 实验现象 | 结论(或化学方程式) |
| 猜想一: K2CO3溶液显 碱性 | 取少量K2CO3溶液 于试管中,滴入2-3 滴酚酞试液,振荡 | 无色变红色 | 溶液显碱性 |
| 猜想二: 能与酸反应 | 取少量K2CO3溶液 于试管中,然后滴加 稀盐酸 | 有大量气泡产生 | 化学方程式 K2CO3+2HCl=2KCl+H2O+CO2↑ |
| 猜想三: 能与Ca(OH)2 反应 | 取少量K2CO3溶液 于试管中,滴加澄清 石灰水 | 产生白色沉淀 | 化学方程式 Ca(OH)2+K2CO3=CaCO3↓+2KOH |
| 猜想四: 能与BaCl2反 应 | 取少量K2CO3溶液于试管中,滴加2-3滴氯化钡溶液 | 产生白色沉淀 | K2CO3+BaCl2=BaCO3↓+2KCl 反应的基本类型为复分解反应 |
13.某化学兴趣小组围绕“酸碱中和反应”,在老师引导下开展探究活动.
探究Ⅰ:证明氢氧化钠溶液与稀盐酸确实能发生反应.
【方案1】测定稀盐酸与NaOH溶液混合前后的pH.
测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果可以认为稀盐酸与NaOH溶液发生了反应,你认为他们的结论是否正确:不正确,理由氢氧化钠溶液中加水稀释pH也会减小.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH 小于7.
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.
【方案2】借助于无色酚酞试液.
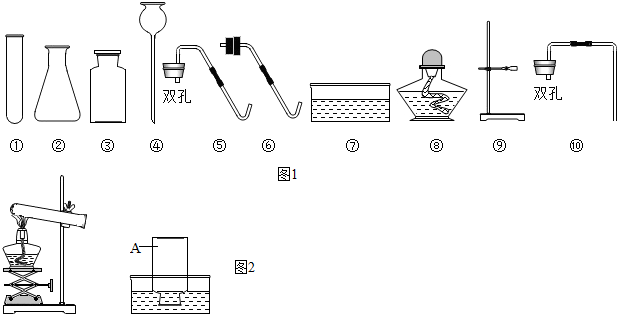
【药品仪器】如图1
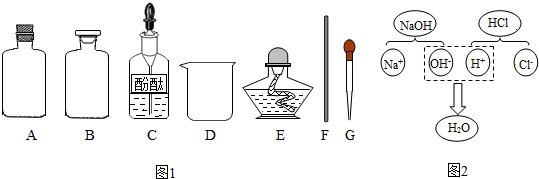
①取A(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:取少量水将其溶解加入CuSO4溶液,无蓝色沉淀.
(2)探究步骤②中无色溶液中稀盐酸是否过量.
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选取了AgNO3溶液、紫色石蕊试液、Na2CO3粉末设计实验方案,请你分析并判断:
方案③中反应的化学方程式6HCl+Fe2O3═Fe2Cl3+3H2O.上述设计方案中,不正确的是①(填“①”、“②”或“③”),错误的原因是反应生成的NaCl也能与AgNO3反应生成白色沉淀,不能证明溶液中含有盐酸.
请你再设计一个与上述实验不同原理的方案以确定稀盐酸是否过量,你选用的试剂是Na2CO3溶液或锌等.
(3)不是所有的碱与盐酸反应都无明显现象,例如Cu(OH)2(填一种碱)与盐酸反应就有明显的实验现象.
探究Ⅱ:从微观的角度认识物质及其变化的本质.图2表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是氢离子和氢氧根离子;结合生成水.请写出一个与上述反应本质相同的化学方程式:2NaOH+H2SO4=Na2SO4+2H2O.
0 165019 165027 165033 165037 165043 165045 165049 165055 165057 165063 165069 165073 165075 165079 165085 165087 165093 165097 165099 165103 165105 165109 165111 165113 165114 165115 165117 165118 165119 165121 165123 165127 165129 165133 165135 165139 165145 165147 165153 165157 165159 165163 165169 165175 165177 165183 165187 165189 165195 165199 165205 165213 211419
探究Ⅰ:证明氢氧化钠溶液与稀盐酸确实能发生反应.
【方案1】测定稀盐酸与NaOH溶液混合前后的pH.
测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果可以认为稀盐酸与NaOH溶液发生了反应,你认为他们的结论是否正确:不正确,理由氢氧化钠溶液中加水稀释pH也会减小.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH 小于7.
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.
【方案2】借助于无色酚酞试液.
【药品仪器】如图1

①取A(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:取少量水将其溶解加入CuSO4溶液,无蓝色沉淀.
(2)探究步骤②中无色溶液中稀盐酸是否过量.
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选取了AgNO3溶液、紫色石蕊试液、Na2CO3粉末设计实验方案,请你分析并判断:
| 实验方案 | 实验步骤 | 现 象 | 结 论 |
| ① | 取样,加入适量的AgNO3溶液 | 出现白色沉淀 | 稀盐酸过量 |
| ② | 取样,加入几滴紫色石蕊试液 | 溶液变红 | 稀盐酸过量 |
| ③ | 取样,加入铁锈粉末 | 红棕色粉末逐渐减少,溶液变成黄色 | 稀盐酸过量 |
请你再设计一个与上述实验不同原理的方案以确定稀盐酸是否过量,你选用的试剂是Na2CO3溶液或锌等.
(3)不是所有的碱与盐酸反应都无明显现象,例如Cu(OH)2(填一种碱)与盐酸反应就有明显的实验现象.
探究Ⅱ:从微观的角度认识物质及其变化的本质.图2表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是氢离子和氢氧根离子;结合生成水.请写出一个与上述反应本质相同的化学方程式:2NaOH+H2SO4=Na2SO4+2H2O.

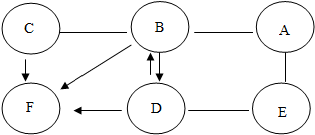
 ”表示两种物质可以发生反应,用“
”表示两种物质可以发生反应,用“ ”表示一种物质反应生成另一种物质,如图所示.已知:A与E能发生置换反应,B与A、C反应均有气泡生成.
”表示一种物质反应生成另一种物质,如图所示.已知:A与E能发生置换反应,B与A、C反应均有气泡生成.