题目内容
17.用A、B、C、D、E、F六个圆表示铁,稀盐酸,碳酸钠溶液,硫酸铜溶液,氯化钡溶液,氯化钠溶液中的某种物质.用“ ”表示两种物质可以发生反应,用“
”表示两种物质可以发生反应,用“ ”表示一种物质反应生成另一种物质,如图所示.已知:A与E能发生置换反应,B与A、C反应均有气泡生成.
”表示一种物质反应生成另一种物质,如图所示.已知:A与E能发生置换反应,B与A、C反应均有气泡生成.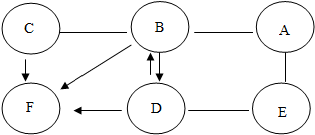
(1)写出B与D之间转化的化学方程式:BaCO3+2HCl=BaCl2+H2O+CO2↑,BaCl2+H2SO4=BaSO4↓+2HCl;
(2)写出A、E反应的实验现象银白色固体表面有紫红色固体析出,溶液由蓝色变为浅绿色;
(3)将各物质对应的化学式填在图中.
分析 根据A、B、C、D、E、F六个圆表示铁、稀盐酸、碳酸钠溶液、硫酸铜溶液、氯化钡溶液、氯化钠溶液中的一种,B与A、C反应均有气泡生成,盐酸和碳酸钠、铁会生成气体,所以B是盐酸,A、C是铁和碳酸钠中的一种,A与E能发生置换反应,所以A是铁,C是碳酸钠,E是硫酸铜,盐酸和D可以相互转化,所以D是氯化钡,F是氯化钠,然后将推出的物质进行验证即可.
解答 解:A、B、C、D、E、F六个圆表示铁、稀盐酸、碳酸钠溶液、硫酸铜溶液、氯化钡溶液、氯化钠溶液中的一种,B与A、C反应均有气泡生成,盐酸和碳酸钠、铁会生成气体,所以B是盐酸,A、C是铁和碳酸钠中的一种,A与E能发生置换反应,所以A是铁,C是碳酸钠,E是硫酸铜,盐酸和D可以相互转化,所以D是氯化钡,F是氯化钠,经过验证,推导正确,所以
(1)B与D之间转化的反应是碳酸钡和盐酸反应生成氯化钡、水和二氧化碳,氯化钡和硫酸反应生成硫酸钡沉淀和盐酸,化学方程式为:BaCO3+2HCl=BaCl2+H2O+CO2↑,BaCl2+H2SO4=BaSO4↓+2HCl;
(2)A、E的反应是铁和硫酸铜反应生成硫酸亚铁和铜,实验现象为:银白色固体表面有紫红色固体析出,溶液由蓝色变为浅绿色;
(3)通过推导可知,A是铁,B是盐酸,C是碳酸钠,D是氯化钡,E是硫酸铜,F是氯化钠,所以
故答案为:(1)BaCO3+2HCl=BaCl2+H2O+CO2↑,BaCl2+H2SO4=BaSO4↓+2HCl;
(2)银白色固体表面有紫红色固体析出,溶液由蓝色变为浅绿色;
(3)
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
8.向硝酸银、硝酸铜的混合溶液中加入一些铁粉,等完全反应后再过滤.下列情况不可能出现的是( )
| A. | 滤纸上若有Ag,滤液中可能有有Fe2+、Cu2+、Ag+ | |
| B. | 滤纸上若有Ag、Cu,滤液中不可能有Ag+ | |
| C. | 滤纸上若有Ag、Cu、Fe,滤液中一定只有Fe2+ | |
| D. | 滤纸上若有Ag、Cu、Fe,滤液中可能有Cu2+、Ag+ |

 如图是A、B、C三种物质的溶解度曲线,请回答:
如图是A、B、C三种物质的溶解度曲线,请回答: 某补钙药剂的标签主要内容如图所示,为测定该钙片含量是否符合标注,做如下实验:取10片该钙片粉碎,放人干燥、洁净的烧杯中,再向烧杯中加入50g稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的总质量为64.5g.
某补钙药剂的标签主要内容如图所示,为测定该钙片含量是否符合标注,做如下实验:取10片该钙片粉碎,放人干燥、洁净的烧杯中,再向烧杯中加入50g稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的总质量为64.5g.