7.“家”是一个化学小世界,蕴含丰富的化学知识.
①碳酸饮料中常加入防腐剂--苯甲酸(C6H5COOH).该防腐剂由3种元素组成,属于有机物(填“有机物”或“无机物”).
②生石灰是种食品干燥剂,其化学式为CaO;热的纯碱溶液可洗涤油污,纯碱的化学式为Na2CO3.
③如表为几种家用清洁剂的功能及有效成分:
Ⅰ.大理石地面能否用“洁厕灵”清洗不能(填“能”或“不能”).
Ⅱ.欲测定“洁厕灵”的酸碱度,可选用A(填字母选项).
A.pH试纸 B.酚酞溶液 C.石蕊溶液
Ⅲ.向“活氧彩漂”液体中加入少量二氧化锰后产生大量气泡,写出该反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
Ⅳ.“洁厕灵”与“漂白精”不能混用,二者混合易产生一种有毒气体X.反应
原理为:NaClO+2HCl→NaCl+X↑+H2O,则X的化学式为Cl2.
①碳酸饮料中常加入防腐剂--苯甲酸(C6H5COOH).该防腐剂由3种元素组成,属于有机物(填“有机物”或“无机物”).
②生石灰是种食品干燥剂,其化学式为CaO;热的纯碱溶液可洗涤油污,纯碱的化学式为Na2CO3.
③如表为几种家用清洁剂的功能及有效成分:
| 名 称 | 洁厕灵 | 活氧彩漂 | 漂白精 |
| 功 能 | 有效清除污垢与异味 | 漂洗使衣物色彩鲜艳 | 快速漂除衣物污渍 |
| 有效成分 | HCl | H2O2 | NaClO |
Ⅱ.欲测定“洁厕灵”的酸碱度,可选用A(填字母选项).
A.pH试纸 B.酚酞溶液 C.石蕊溶液
Ⅲ.向“活氧彩漂”液体中加入少量二氧化锰后产生大量气泡,写出该反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
Ⅳ.“洁厕灵”与“漂白精”不能混用,二者混合易产生一种有毒气体X.反应
原理为:NaClO+2HCl→NaCl+X↑+H2O,则X的化学式为Cl2.
6.用数轴表示某些化学知识直观、简明、易记.下列数轴表示的化学知识,错误的是( )
| A. | 地壳中部分元素的含量关系 | B. | 生活中常见物质的pH: | ||
| C. | 空气中部分成分的体积关系 | D. | 一些物质的着火点 |
5.下列变化属于化学变化的是( )
| A. |  人工降雨 | B. |  水果榨汁 | C. |  硫在氧气中燃烧 | D. |  活性炭吸附 |
2.世界上最轻的材料--碳海绵,其密度只有空气的$\frac{1}{7}$.它的主要成分是石墨烯和碳纳米管(两者都是碳单质).下列关于碳海绵的说法中不正确的是( )
| A. | 常温下化学性质活泼 | B. | 具有吸附性 | ||
| C. | 在一定条件下可还原氧化铜 | D. | 在氧气中完全燃烧的产物是CO2 |
1.下列实验现象和对应的结论描述都正确的是( )
| A. | 向某固体上滴加稀盐酸,有气泡产生--该固体一定是碳酸盐 | |
| B. | 向某无色溶液中滴入酚酞试液,溶液变红色--该溶液一定是碱溶液 | |
| C. | 某固态化肥与熟石灰混合研磨后产生氨气--该化肥一定是铵态氮肥 | |
| D. | 把燃着的木条伸入某无色气体中,木条熄灭--该气体一定是二氧化碳 |
19.废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如图所示:
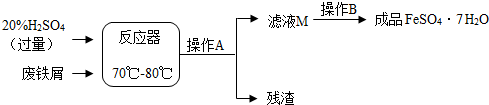
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外,写出发生的其他一个化学反应方程式:Fe+H2SO4=FeSO4+H2↑或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)在实验室中操作A是过滤;
(3)滤液M经过操作B可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
根据溶解度表,要得到纯净的硫酸亚铁晶体(FeSO4•7H2O),冷却结晶温度应该低于64℃;待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次.用冰水洗涤的目的是:Ⅰ除去晶体表面附着的杂质;Ⅱ减少晶体溶解,提高产率.
(4)在化学反应中,将有元素化合价变化的反应定义为氧化还原反应.在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它氧化物,试写出该氧化还原反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3.
0 164938 164946 164952 164956 164962 164964 164968 164974 164976 164982 164988 164992 164994 164998 165004 165006 165012 165016 165018 165022 165024 165028 165030 165032 165033 165034 165036 165037 165038 165040 165042 165046 165048 165052 165054 165058 165064 165066 165072 165076 165078 165082 165088 165094 165096 165102 165106 165108 165114 165118 165124 165132 211419

(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外,写出发生的其他一个化学反应方程式:Fe+H2SO4=FeSO4+H2↑或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)在实验室中操作A是过滤;
(3)滤液M经过操作B可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |
| 析出 晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | ||||||||
(4)在化学反应中,将有元素化合价变化的反应定义为氧化还原反应.在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它氧化物,试写出该氧化还原反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3.



