8.下列几种常见的饮料中,不含有机物的可能是( )
| A. | 矿泉水 | B. | 果汁 | C. | 啤酒 | D. | 牛奶 |
7.含有铵根离子的物质称为农业生产中的铵态氮肥,如表是氮肥氧化铵不同温度下的溶解度:
(1)从表中可知:在70℃时,50g水中最多溶解氯化铵30.1克.
(2)烧杯A是70℃时,含有100g水的氯化铵不饱和溶液,经过如图的变化过程(在整个过程中不考虑水分的蒸发),则到C烧杯时,溶液的质量为137.2g.
(3)如图所示,是对氯化铵性质的探究实验:

①图1说明氯化铵溶液水会吸收热量;
②图2是观察到湿润红色石蕊试纸变蓝色;
③农业生产中不能(填“能”或“不能”)将铵态氮肥与碱性物质混用.
| 温度℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 溶解度(g/100g水) | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.0 | 60.2 |
(2)烧杯A是70℃时,含有100g水的氯化铵不饱和溶液,经过如图的变化过程(在整个过程中不考虑水分的蒸发),则到C烧杯时,溶液的质量为137.2g.
(3)如图所示,是对氯化铵性质的探究实验:

①图1说明氯化铵溶液水会吸收热量;
②图2是观察到湿润红色石蕊试纸变蓝色;
③农业生产中不能(填“能”或“不能”)将铵态氮肥与碱性物质混用.
6.“低钠盐”可以控制钠的摄入量从而防治高血压等疾病.制备“低钠盐”在食盐中用NaCl中按照配方比例添加食用KCl.国内某些生产厂家为改变“低钠盐”口味还会加入少量镁盐(仅限MgSO4或MgCl2).
(1)测得某“低钠盐”样品a中含有NaCl和KCl的质量分数均为50%.该样品a的水溶液中,含量最多的离子是Cl-(填离子符号).
(2)探究某“低钠盐”样品b中是否添加镁盐,以及添加的是何种镁盐(MgSO4或MgCl2中的一种).请设计实验方案,完成下列表格.
限选试剂:BaCl2溶液、NaOH溶液、AgNO3溶液、蒸馏水
(1)测得某“低钠盐”样品a中含有NaCl和KCl的质量分数均为50%.该样品a的水溶液中,含量最多的离子是Cl-(填离子符号).
(2)探究某“低钠盐”样品b中是否添加镁盐,以及添加的是何种镁盐(MgSO4或MgCl2中的一种).请设计实验方案,完成下列表格.
限选试剂:BaCl2溶液、NaOH溶液、AgNO3溶液、蒸馏水
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品b于烧杯中,加足量蒸馏水,并用玻璃棒搅拌 | 样品溶解,形成无色溶液. |
| 步骤2:取少量步骤1形成的溶液于试管中,在滴加少量NaOH溶液,振荡 | 有白色沉淀生成,说明样品b中添加了镁盐 |
| 步骤3:取少量步骤1形成的溶液于试管中,再滴加少量的BaCl2溶液振荡 | 若有白色沉淀产生,则添加的是MgSO4.若无明显现象,则添加的是MgCl2 |
4.实验室部分装置如图所示,请回答下列问题.

(1)选择发生和收集O2的装置,填写在下表中(填字母).
(2)如果用MnO2与浓H2SO4加热制备O2,可选用的发生装置是C(填字母).
(3)选用F装置收集气体时,下列实验操作正确的是①②③(填序号).
①反应前,将集气瓶注满水,用玻璃片盖着瓶口,倒立在盛水的水槽中
②开始反应后,等到气泡连续且均匀时,再将导管口移入集气瓶
③收集气体后,将集气瓶盖上玻璃片再移出水槽
(4)实验室用KMnO4制备O2的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.若需制备3.2g O2,至少需要消耗31.6g KMnO4.(已知KMnO4的相对分子质量为158)

(1)选择发生和收集O2的装置,填写在下表中(填字母).
| 选用药品 | 发生装置 | 收集装置 |
| H2O2溶液、MnO2 | B | D或F |
| KMnO4 | A |
(3)选用F装置收集气体时,下列实验操作正确的是①②③(填序号).
①反应前,将集气瓶注满水,用玻璃片盖着瓶口,倒立在盛水的水槽中
②开始反应后,等到气泡连续且均匀时,再将导管口移入集气瓶
③收集气体后,将集气瓶盖上玻璃片再移出水槽
(4)实验室用KMnO4制备O2的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.若需制备3.2g O2,至少需要消耗31.6g KMnO4.(已知KMnO4的相对分子质量为158)
1.碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”.实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量NaC1,加热到一定温度,持续通入SO2,待反应一定时间,过滤得到粗碲.
(1)反应的总化学方程式为:TeOSO4+2SO2+3X$\frac{\underline{\;\;△\;\;}}{\;}$Te↓+3H2SO4,则X为H2O(填化学式).
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaC1浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
①该小组研究的反应条件是温度和反应时间.
②实验a和b的目的是比较相同时间,不同的反应温度对粗碲沉淀率的影响.
③在上述四组实验中,最佳的反应条件是80℃和2.0h.
④为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率.若再设计对比实验,选择的反应条件还可以是A(填选项).
A.80℃,1.5h B.80℃,2.5h C.70℃,2.0h D.95℃,2.0h.
0 164197 164205 164211 164215 164221 164223 164227 164233 164235 164241 164247 164251 164253 164257 164263 164265 164271 164275 164277 164281 164283 164287 164289 164291 164292 164293 164295 164296 164297 164299 164301 164305 164307 164311 164313 164317 164323 164325 164331 164335 164337 164341 164347 164353 164355 164361 164365 164367 164373 164377 164383 164391 211419
(1)反应的总化学方程式为:TeOSO4+2SO2+3X$\frac{\underline{\;\;△\;\;}}{\;}$Te↓+3H2SO4,则X为H2O(填化学式).
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaC1浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
| 实验 | 温度/℃ | 反应时间/h | 粗蹄沉淀率 |
| a | 65 | 3.0 | 65.0 |
| b | 80 | 3.0 | 98.9 |
| c | 80 | 2.0 | 98.9 |
| d | 90 | 2.0 | 97.0 |
②实验a和b的目的是比较相同时间,不同的反应温度对粗碲沉淀率的影响.
③在上述四组实验中,最佳的反应条件是80℃和2.0h.
④为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率.若再设计对比实验,选择的反应条件还可以是A(填选项).
A.80℃,1.5h B.80℃,2.5h C.70℃,2.0h D.95℃,2.0h.
 配制并稀释一定质量分数的Na2SO4溶液.
配制并稀释一定质量分数的Na2SO4溶液. 实验室有如图所示装置,回答下列问题:
实验室有如图所示装置,回答下列问题: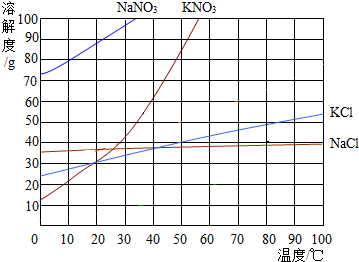 如图为几种固体的溶解度曲线,回答下列问题:
如图为几种固体的溶解度曲线,回答下列问题: 盐酸是一种重要的化工产品,也是实验室中重要的化学试剂.
盐酸是一种重要的化工产品,也是实验室中重要的化学试剂. H+,
H+, Cl-,
Cl-, Fe2+.
Fe2+.