6.欲证明生石灰中含有未分解的石灰石,最简单的方法是( )
| A. | 滴加稀盐酸 | B. | 加热 | C. | 加入石灰石 | D. | 加入Na2CO3 |
5.HCl、Cl2、NaCl中的氯元素具有相同的( )
| A. | 核外电子数 | B. | 化学性质 | ||
| C. | 核电荷数 | D. | 化合价及带电荷数 |
4.对下列物质用途的描述,不符合事实的是( )
| A. | 石墨可以制铅笔芯 | B. | 二氧化碳可用作气体肥料 | ||
| C. | 氮气是食品包装袋中的一种防腐剂 | D. | 活性炭可以用于软化硬水 |
20.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开始探究活动.以下是教学片断,请你参与学习并帮助填写空格(包括表中空格).
【查阅资料】Na2SO4溶液呈中性
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
Ⅰ.定性探究
【提出问题】反应后溶液中溶质是什么呢?
【猜想】针对疑问大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的,你认为不合理的猜想是哪种并说出理由猜想四H2SO4和NaOH在溶液中不能共存.
【继续试验】(1)丙组同学取烧杯中的少量溶液于试管中,滴加几滴酚酞溶液,无明显变化,溶液中一定没有NaOH或氢氧化钠.
(2)为了验证其余猜想,各组同学取烧杯中的溶液,丙选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,分别进行如下三组探究实验.
【得出结论】通过探究,全班同学一直确定猜想二是正确的.
【评价反思、老师对同学能用多种方法进行探究,并且得出正确结论给予肯定,同时也指出上述三个实验探究中也有一个是不合理的,这个方案是③(选填①、②、③),你还可以选择锌粒(填药品名称)进行实验,也能得出同样的结论.
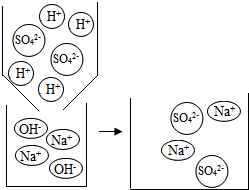
【剖析本质】实验后,老师又带领大家从微观的角度来理解此反应的实质,请你和同学们一起在反应后的方框中补画未画全的微粒.
Ⅰ.定量探究
取上述【演示实验】反应后烧杯中的溶液100g,设计如下实验:
试计算上述【演示实验】反应后溶液中Na2SO4的质量分数是多少?(列出计算过程)
0 162773 162781 162787 162791 162797 162799 162803 162809 162811 162817 162823 162827 162829 162833 162839 162841 162847 162851 162853 162857 162859 162863 162865 162867 162868 162869 162871 162872 162873 162875 162877 162881 162883 162887 162889 162893 162899 162901 162907 162911 162913 162917 162923 162929 162931 162937 162941 162943 162949 162953 162959 162967 211419
【查阅资料】Na2SO4溶液呈中性
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
Ⅰ.定性探究
【提出问题】反应后溶液中溶质是什么呢?
【猜想】针对疑问大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的,你认为不合理的猜想是哪种并说出理由猜想四H2SO4和NaOH在溶液中不能共存.
【继续试验】(1)丙组同学取烧杯中的少量溶液于试管中,滴加几滴酚酞溶液,无明显变化,溶液中一定没有NaOH或氢氧化钠.
(2)为了验证其余猜想,各组同学取烧杯中的溶液,丙选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,分别进行如下三组探究实验.
| 实验方案 | ①测溶液pH | ②滴加Na2CO3溶液 | ③滴加BaCl2溶液 |
| 实验现象 | 试纸变色,与标准比色卡比照,得pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思、老师对同学能用多种方法进行探究,并且得出正确结论给予肯定,同时也指出上述三个实验探究中也有一个是不合理的,这个方案是③(选填①、②、③),你还可以选择锌粒(填药品名称)进行实验,也能得出同样的结论.
【剖析本质】实验后,老师又带领大家从微观的角度来理解此反应的实质,请你和同学们一起在反应后的方框中补画未画全的微粒.

Ⅰ.定量探究
取上述【演示实验】反应后烧杯中的溶液100g,设计如下实验:

试计算上述【演示实验】反应后溶液中Na2SO4的质量分数是多少?(列出计算过程)
 今年我市初中化学实验操作参考的实验有六个,现选取部分同学抽取的实验,请你回答下列问题:
今年我市初中化学实验操作参考的实验有六个,现选取部分同学抽取的实验,请你回答下列问题: (1)请从H、C、O、Cl、Na中选择适当的元素组成符合下列要求的物质的化学式:
(1)请从H、C、O、Cl、Na中选择适当的元素组成符合下列要求的物质的化学式: