4.下列物质能与硫酸溶液发生复分解反应,而且效果明显的是( )
| A. | 无锈铁钉 | B. | 完全锈蚀的铁钉 | C. | 铜钉 | D. | 硫酸铜 |
20.下列做法符合科学道理的是( )
| A. | 用大量亚硝酸钠(Na2NO2)腌渍食品 | |
| B. | 用冷却结晶的方法从海水中提取粗盐 | |
| C. | 用含有氢氧化铝的药物治疗胃酸过多的病人 | |
| D. | 被黄蜂刺了(刺液呈碱性),涂上稀硫酸以减轻痛痒 |
19.小明用下列方法配制氯化钠溶液,不能得到溶质的质量分数为15%的溶液的是( )
| A. | 100g水中加入15g氯化钠全部溶解 | |
| B. | 将氯化钠与水按照3:17的质量比进行充分溶解 | |
| C. | 将30g氯化钠溶解于水中充分搅拌得到200g溶液 | |
| D. | 20℃时,将15g氯化钠溶解在85g水中并充分搅拌 |
18.下列选项中与NaOH 溶液,BaCl2溶液,Zn、Na2CO3 四种物质均能发生反应的是( )
| A. | 熟石灰 | B. | 稀盐酸 | C. | 硫酸铜 | D. | 二氧化碳 |
17.辽宁省探索出了“政府测土、专家配方、农民来造自己的私家肥”的配方肥供应模式.专家根据检测结果建议某块田应该加氮肥.下列物质可用作氮肥的是( )
| A. | HNO3 | B. | KCl | C. | NH4NO3 | D. | Ca3(PO4)2 |
15.某学习小组对课本中“食盐常用于制作纯碱”的内容产生兴趣在老师的指导下,获悉:
NaCl+NH3 +CO2 ═NaHCO3 ↓+NH4Cl
将经过过滤、洗涤得到的NaHCO3 微小晶体,在加热煅烧制得纯碱产品.
2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+H2O+CO2↑
探究活动.测定制得产品中碳酸钠的纯度
【实验1】用气化发测定
甲组同学为了测定该产品中碳酸钠的纯度,进行了一下实验,取17.0g纯碱样品放入烧杯中,将烧杯放在电子天平上,再把150.0g稀盐酸(足量)加入样品中,观察读数变化如下表所示:
(1)实验中产生的CO2气体质量为6.6g;
(2)该产品中碳酸钠的质量分数(结果精确到0.1%)93.5%.
【反思与评价】
(3)加热煅烧NaHCO3后,得到固体样品中的成分为碳酸钠.
【实验2】用沉淀法测定
资料摘要:碳酸钠与氯化镁在溶液中发生反应:Na2CO3+MgCl2═Mg(CO3)2↓+2NaCl.
乙组同学按如图所示的实验步骤进行实验:
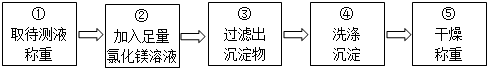
(4)步骤②加入的氯化镁溶液必需足量,其目的是使碳酸钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加碳酸钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
0 162537 162545 162551 162555 162561 162563 162567 162573 162575 162581 162587 162591 162593 162597 162603 162605 162611 162615 162617 162621 162623 162627 162629 162631 162632 162633 162635 162636 162637 162639 162641 162645 162647 162651 162653 162657 162663 162665 162671 162675 162677 162681 162687 162693 162695 162701 162705 162707 162713 162717 162723 162731 211419
NaCl+NH3 +CO2 ═NaHCO3 ↓+NH4Cl
将经过过滤、洗涤得到的NaHCO3 微小晶体,在加热煅烧制得纯碱产品.
2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+H2O+CO2↑
探究活动.测定制得产品中碳酸钠的纯度
【实验1】用气化发测定
甲组同学为了测定该产品中碳酸钠的纯度,进行了一下实验,取17.0g纯碱样品放入烧杯中,将烧杯放在电子天平上,再把150.0g稀盐酸(足量)加入样品中,观察读数变化如下表所示:
| 时间/t | 0 | 5 | 10 | 15 |
| 读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
(2)该产品中碳酸钠的质量分数(结果精确到0.1%)93.5%.
【反思与评价】
(3)加热煅烧NaHCO3后,得到固体样品中的成分为碳酸钠.
【实验2】用沉淀法测定
资料摘要:碳酸钠与氯化镁在溶液中发生反应:Na2CO3+MgCl2═Mg(CO3)2↓+2NaCl.
乙组同学按如图所示的实验步骤进行实验:

(4)步骤②加入的氯化镁溶液必需足量,其目的是使碳酸钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加碳酸钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
 如图所示,如果挤压胶头滴管,并取下胶帽,便可发现喷泉现象,请说出水槽中液体(与胶头滴管内液体相同)和烧瓶中气体的可能成分(至少写出两种情况),并分析他们是利用了物质的什么性质,发生什么变化,如果是化学变化,请写出化学方程式.
如图所示,如果挤压胶头滴管,并取下胶帽,便可发现喷泉现象,请说出水槽中液体(与胶头滴管内液体相同)和烧瓶中气体的可能成分(至少写出两种情况),并分析他们是利用了物质的什么性质,发生什么变化,如果是化学变化,请写出化学方程式.