18.以下归纳中不正确的是( )
| A. | 分子、原子和离子都是构成物质的基本粒子 | |
| B. | 最外层电子数为8的粒子不一定是稀有气体原子 | |
| C. | 核内质子数相同的原子属于同一种元素 | |
| D. | 在化学反应中,原子可分,而分子却不能再分 |
17.在开展呼吸作用的实验研究之前,小雨根据生物学知识指出:“人体呼吸时,呼出的气体中可能比吸入的气体含较多的水蒸气”.这在科学研究环节中属于( )
| A. | 解释与结论 | B. | 观察与问题 | C. | 实验与事实 | D. | 假设与预测 |
15.硝酸钾的溶解度随温度升高而增大,将一杯室温下恰好饱和的硝酸钾溶液变为不饱和溶液,应选择( )
| A. | 加水 | B. | 降温 | C. | 取出部分溶液 | D. | 恒温下加溶质 |
14.从分子的角度,如图所示说明了( )


| A. | 分子是由原子构成的 | B. | 分子在不断地运动 | ||
| C. | 分子的质量和体积都很小 | D. | 分子间存在间隔 |
12.类推是化学学习中常用的思维方法,以下类推结果中正确的是( )
| A. | 铝与盐酸反应生成AlCl3和H2,则金属铁与盐酸反应生成FeCl2和H2 | |
| B. | 化学反应前后由于原子种类不变,所以元素种类不变 | |
| C. | 向某固体滴加稀盐酸,若有气泡产生,则固体中一定含有碳酸根 | |
| D. | 有机物一定含碳元素,含碳元素的化合物也一定是有机物 |
11.市场上有一种罐装食品,在罐的夹层中分别装入一种固体物质和水,食用前振动罐头使它们混合,罐内温度就会升高,对食品预热,这种物质可能是( )
| A. | 硝酸铵 | B. | 生石灰 | C. | 浓硫酸 | D. | 氢氧化钠 |
9.某化工厂用石灰石和废铜屑等设计生产石青、波尔多液的工艺流程如下:
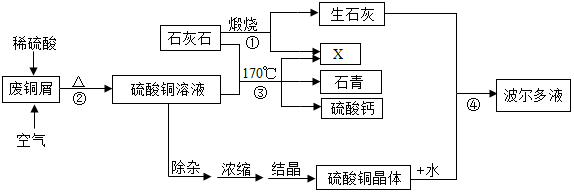
一、产品制备
(1)流程图中X的化学式为CO2;
(2)反应②的总化学方程式为2H2SO4+2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(3)硫酸铜晶体(CuSO4•5H2O)的溶解度如下表:
蒸发浓缩后热溶液经处理大量析出晶体,温度到达30℃时,剩余硫酸铜溶液的溶质质量分数为20%;待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,用冰水洗涤的目的是:
Ⅰ是除去晶体表面的杂质;Ⅱ是0℃时,硫酸铜溶解度较小,损失少.
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其化学方程式为:
Ⅰ是CaO+H2O═Ca(OH)2;Ⅱ是Ca(OH)2+CuSO4═CaSO4+Cu(OH)2↓.
二、组成测定
查阅资料得知,石青的化学式可表示为aCuCO3•bCu(OH)2,已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃.为测定其组成,小组同学称取石青样品34.6g,用如图装置进行实验.
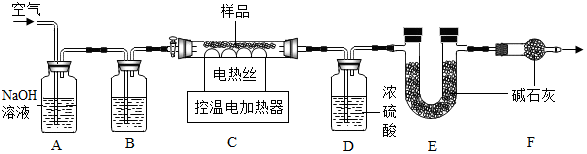
(5)洗气瓶A中氢氧化钠溶液的作用是除去空气中的二氧化碳;B中所装液体为浓硫酸.
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g.通过计算可得:a:b=2:1..
(7)若缺少F装置,测得的a:b偏大(选填“偏大”、“偏小”、“不变”).
三、脱水探究
硫酸铜晶体受热会逐步失去结晶水.取纯净CuSO4•5H2O固体2.50g,放在如图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示.
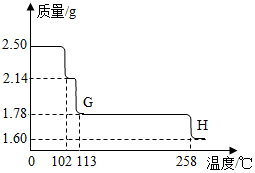
(8)G点固体的化学式是CuSO4•H2O.
(9)G→H看到的现象是白色.
(10)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑+5H2O↑.
0 155618 155626 155632 155636 155642 155644 155648 155654 155656 155662 155668 155672 155674 155678 155684 155686 155692 155696 155698 155702 155704 155708 155710 155712 155713 155714 155716 155717 155718 155720 155722 155726 155728 155732 155734 155738 155744 155746 155752 155756 155758 155762 155768 155774 155776 155782 155786 155788 155794 155798 155804 155812 211419

一、产品制备
(1)流程图中X的化学式为CO2;
(2)反应②的总化学方程式为2H2SO4+2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(3)硫酸铜晶体(CuSO4•5H2O)的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
Ⅰ是除去晶体表面的杂质;Ⅱ是0℃时,硫酸铜溶解度较小,损失少.
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其化学方程式为:
Ⅰ是CaO+H2O═Ca(OH)2;Ⅱ是Ca(OH)2+CuSO4═CaSO4+Cu(OH)2↓.
二、组成测定
查阅资料得知,石青的化学式可表示为aCuCO3•bCu(OH)2,已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃.为测定其组成,小组同学称取石青样品34.6g,用如图装置进行实验.

(5)洗气瓶A中氢氧化钠溶液的作用是除去空气中的二氧化碳;B中所装液体为浓硫酸.
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g.通过计算可得:a:b=2:1..
(7)若缺少F装置,测得的a:b偏大(选填“偏大”、“偏小”、“不变”).
三、脱水探究
硫酸铜晶体受热会逐步失去结晶水.取纯净CuSO4•5H2O固体2.50g,放在如图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示.

(8)G点固体的化学式是CuSO4•H2O.
(9)G→H看到的现象是白色.
(10)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑+5H2O↑.




