19.下列实验方法中不能达到目的是( )
| A. | 用肥皂水鉴别蒸馏水和氯化钙溶液 | |
| B. | 用水鉴别氯化钠固体和硫酸铜固体 | |
| C. | 用闻气味的方法鉴别白酒和白醋 | |
| D. | 用燃着的木条区分氮气和二氧化碳气体 |
18.要除去下列物质中的少量杂质,所用的试剂或方法不正确的是( )
| 选项 | 物质 | 少量杂质 | 试剂和方法 |
| A | KCl溶液 | CaCl2 | 通入过量的CO2气体、过滤 |
| B | H2 | O2 | 通过足量灼热的铜网 |
| C | CaO | CaCO3 | 高温煅烧 |
| D | CuSO4溶液 | H2SO4 | 加入足量氧化铜粉末,过滤 |
| A. | A | B. | B | C. | C | D. | D |
13.将等质量等质量分数的烧碱溶液和稀盐酸混合充分反应后,下列各物质不能与混合后的溶液反应的是( )
| A. | CO2 | B. | Mg | C. | AgNO3 | D. | Cu(OH)2 |
12.下列变化需要消耗空气中氧气的是( )
| A. | 干冰在空气中升华 | B. | 铁制品在空气中生锈 | ||
| C. | 浓硫酸在空气中变稀 | D. | 氢氧化钠在空气中变质 |
10.小亮同学想通过实验探究某企业采用的氨碱法制得的纯碱样品的成分及含量.
【提出问题1】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,小亮做出如下假设:
①只含有Na2CO3;②含有Na2CO3和NaHCO3
【查阅资料】
(1)表中的现象I对应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)现象Ⅱ为有白色沉淀产生.
【实验探究】为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成下列实验报告.
【实验反思】实验步骤①中,氯化钙溶液过量的目的是将碳酸钠全部除去
【提出问题2】如何测量该纯碱样品中各物质的含量?
(1)为测量该纯碱样品各成分的含量,小亮设计了如图1装置,通过称量B装置的质量变化来 确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进人装置B的C02与NaOH 均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①空气中的CO2进入装置B被氢氧化钠吸收;②装置A中残留的CO2未被装置B中的氢氧化钠吸收.
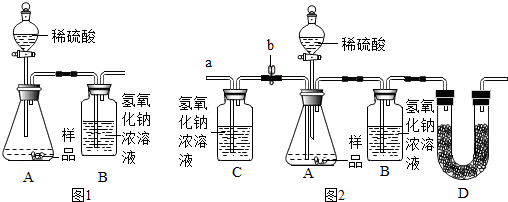
(2)小亮在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①检查装置气密性,将干燥的样品放人锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加人稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓人一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.
该实验的正确步骤是①③②④⑥⑤⑦.
0 147602 147610 147616 147620 147626 147628 147632 147638 147640 147646 147652 147656 147658 147662 147668 147670 147676 147680 147682 147686 147688 147692 147694 147696 147697 147698 147700 147701 147702 147704 147706 147710 147712 147716 147718 147722 147728 147730 147736 147740 147742 147746 147752 147758 147760 147766 147770 147772 147778 147782 147788 147796 211419
【提出问题1】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,小亮做出如下假设:
①只含有Na2CO3;②含有Na2CO3和NaHCO3
【查阅资料】
| NaHCO3 | Na2CO3 | |
| 加人稀盐酸 | 现象Ⅰ | 产生气泡 |
| 加人饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加人CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(2)现象Ⅱ为有白色沉淀产生.
【实验探究】为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成下列实验报告.
| 实验步骤 | 实验现象 | |
| ①取少量样品溶于水,加人过量 的CaCl2溶液. | 有白色沉淀产生 | 该反应的方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl |
| ②将上述反应后的混合液过滤,取滤液. | 有气泡冒出 | 证明猜想②成立. |
【提出问题2】如何测量该纯碱样品中各物质的含量?
(1)为测量该纯碱样品各成分的含量,小亮设计了如图1装置,通过称量B装置的质量变化来 确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进人装置B的C02与NaOH 均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①空气中的CO2进入装置B被氢氧化钠吸收;②装置A中残留的CO2未被装置B中的氢氧化钠吸收.

(2)小亮在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①检查装置气密性,将干燥的样品放人锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加人稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓人一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.
该实验的正确步骤是①③②④⑥⑤⑦.

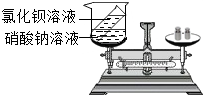 小章同学设计了如图所示的实验来验证质量守恒定律,在实验前左盘总质量为m,将试管中的溶液倒入烧杯后,左盘总质量为m,小章同学认为实验成功,你认为该实验设计合理吗?为什么?
小章同学设计了如图所示的实验来验证质量守恒定律,在实验前左盘总质量为m,将试管中的溶液倒入烧杯后,左盘总质量为m,小章同学认为实验成功,你认为该实验设计合理吗?为什么?