题目内容
9.我市某化工厂排出的废水透明、澄清、略显蓝色.我校化学兴趣小组的同学为了探究其成分进行了如下实验:①取少量废水,加入过量的盐酸,有白色沉淀生成.过滤,向沉淀物中加入足量稀硝酸,白色沉淀不溶解.
②将所得的滤液分成两份,一份滤液中加入适量的稀硫酸,也有白色沉淀生成.过滤,向沉淀物中加入足量稀硝酸,白色沉淀不溶解.
③另一份滤液中加入足量NaOH溶液,产生蓝色沉淀.由上述实验可以推断:(写离子符号)
(1)废水中肯定含有的阳离子是Ag+、Ba2+Cu2+;含有的大量阴离子是NO3-.
(2)实验步骤③中,向滤液中滴加NaOH溶液,开始时观察不到蓝色沉淀,原因是:溶液中有酸,生成的沉淀会与酸反应.
(3)该小组同学设计了一个从废水中除去其阳离子的实验方案:【已知白色的Fe(OH)2固体在潮湿的空气中可生成红褐色的Fe(OH)3】试回答下列问题:
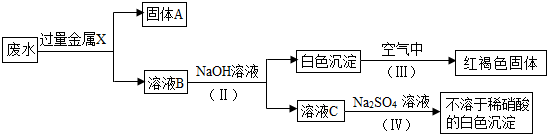
①固体A中一定含有的物质为FeCuAg(写化学式).
②C溶液中的溶质一定含有Ba(NO3)2(写化学式).
③写出Ⅳ中发生反应的化学方程式Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3.
分析 (1)根据氢氧根离子首先与氢离子反应来分析;
(2)由题中的框图可知:已知红褐色固体是氢氧化铁,可知X是金属铁,铁把银、铜置换出来,故固体A为Ag、Cu、Fe;又由于加入过量的铁和出现的白色沉淀,所以B溶液中一定有Fe(NO3)2和Ba(NO3)2.书写化学方程式时要注意配平和沉淀符号.
解答 解:废水和盐酸反应生成不溶于硝酸的白色沉淀是氯化银;由于盐酸是过量的,所以滤液中没有银离子,所以和硫酸反应反应生成不溶于硝酸的白色沉淀是硫酸钡;和氢氧化钠反应生成蓝色沉淀是氢氧化铜;所以废水中含有Ba2+、Ag+、Cu2+;由于存在这些离子,所以不可能含有氯离子、碳酸根离子、硫酸根离子、氢氧根离子,所以阴离子为硝酸根离子.
(1)过滤后,向滤液中滴加NaOH溶液,开始时观察不到蓝色沉淀,原因是盐酸过量;
(2)①由题中的图知:废水加过量固体X,然后向滤液中加氢氧化钠,产生白色沉淀又变成红褐色沉淀,由题中信息知白色沉淀是氢氧化亚铁,红褐色沉淀是氢氧化铁;可知金属X是铁,废水中含有银离子、钡离子和铜离子,铁可将银离子和铜离子置换出来,还有过量的铁,所以固体A中一定含有Fe、Ag和Cu;
②由于溶液中只能含有硝酸根离子,所以B溶液中的溶质一定含有Fe(NO3)2、Ba(NO3)2;加入氢氧化钠溶液,铁离子和氢氧根结合为沉淀,C溶液中的溶质一定含有Ba(NO3)2;
③溶液C为Ba(NO3)2,加入硫酸钠发生反应的方程式为:Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3.
故答案为:
(1)Ag+、Ba2+ Cu2+; NO3-
(2)溶液中有酸,生成的沉淀会与酸反应.
(3)①Fe Cu Ag;
②Ba(NO3)2
③Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3
点评 只有熟练掌握酸碱盐的化学性质才能快速准确的做出这类题的正确答案,本题综合性强,有利于培养学生分析实验解决实验的能力.

①小明对气体的成分进行了猜测:气体中除了醋酸气体和水蒸气之外,还可能含有气体A,A是二氧化碳.
②于是他对气体A的来源做了两种猜测:
猜测1:气体A可能是由碳酸氢钠和醋酸反应生成的;
猜测2:气体A可能是由碳酸氢钠受热分解产生的.
针对以上猜测,小明设计了以下实验:
| 实验步骤 | 实验现象 | |
| 实验1 | ||
| 实验2 | 取碳酸氢钠样品少许加入试管中,加热使之充分反应,并把产生的气体通入澄清石灰水 | 试管口出现小水珠,澄清石灰水变浑浊 |
③实验2中,小明发现充分反应后,试管中仍留有一些白色粉末,他认为除了含碳酸钠外,也可能会含有氢氧化钠;请你帮他设计合适的实验方案来验证猜想实验步骤:取白色粉末适量于试管中,加入足量的水溶解,滴加足量的氯化钙溶液,静置一段时间后滴加酚酞试液;
实验现象:产生白色沉淀,酚酞试液不变色;
实验结论:白色粉末是碳酸钠,不含有氢氧化钠.
| A. | Cu+2AgNO3═Cu(NO3)2+2Ag | B. | 2Na2O2+2CO2═2Na2CO3+O2 | ||
| C. | 2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$ 2MgO+C | D. | 2Al+3H2SO4═A12(SO4)3+3H2↑ |
| A. | H2SO4═H++S2-+O2- | B. | Ba(OH)2═Ba2++OH- | ||
| C. | Mg SO4═Mg2++SO42- | D. | Na2CO3═Na++CO3-2 |
 A、B、C、D、E各代表木炭、氧气、二氧化碳、一氧化碳、氧化铜中的一种,一定条件下,相连环物质间能发生反应(如图),其中A是能使澄清石灰水变浑浊的气体,C具有助燃性.则:
A、B、C、D、E各代表木炭、氧气、二氧化碳、一氧化碳、氧化铜中的一种,一定条件下,相连环物质间能发生反应(如图),其中A是能使澄清石灰水变浑浊的气体,C具有助燃性.则: