题目内容
11.有一瓶未曾使用过的、久置的双氧水,瓶上标签提供了如下信息:H2O2的质量分数为30%,内装溶液质量1000克.经实验测定,现在H2O2的质量分数为10%.则这瓶双氧水中,已分解的H2O2的质量大约为( )| A. | 190克 | B. | 200克 | C. | 210克 | D. | 220克 |
分析 根据反应化学方程式,找出已分解过氧化氢与放出氧气的质量关系,然后利用溶液的溶质质量分数的公式,由剩余溶液的质量分数为10%、剩余过氧化氢的质量=原溶液中过氧化氢质量-已分解的过氧化氢质量、剩余溶液质量=原溶液质量-放出氧气的质量,计算出已反应的过氧化氢的质量.
解答 解:设这瓶双氧水变质过程中减少的过氧化氢的质量为x
2H2O2=2H2O+O2↑
68 32
x $\frac{32x}{68}$
余下溶质H2O2的质量为300g-x,余下溶液的质量为1000g-$\frac{32x}{68}$.
再根据变质后溶液中溶质的质量分数为10%列出等式:$\frac{1000g×30%-x}{1000g-\frac{32x}{68}}×100%$=10% 解得:x=209.9g
答:计算这瓶双氧水中已分解的过氧化氢的质量是209.9g.
故选:C.
点评 在使用久置的双氧水溶液加水生杀予稀释配制医用双氧水时,要注意所使用的双氧水的质量分数已不再是标签上所注明的30%,这是解答本题时要引起注意的.

练习册系列答案
相关题目
16.仔细观察下列四幅图片,属于模型的选项是( )
| A. |  红十字会 | B. |  眼球结构 | ||
| C. |  注意行人 | D. |  食品质量安全标志 |
1.下列用途中,不属于氢氧化钙的用途是( )
| A. | 在农业上常用来改良酸性土壤 | B. | 用作建筑材料,用来抹墙 | ||
| C. | 常用来检验铵盐的存在 | D. | 广泛用于制肥皂、造纸等工业 |

 2012年4月15日,央视《每周质量报告》曝光一些企业用生石灰处理皮革废料熬制工业明胶,制成药用胶囊,最终进入消费者腹中.工业明胶,是一种淡黄色或棕色的碎粒,无不适气味,无肉眼可见杂质.其分子量为1-10万,水分和无机盐含量在16%以下,蛋白质含量在82%以上,是一种理想的蛋白源.
2012年4月15日,央视《每周质量报告》曝光一些企业用生石灰处理皮革废料熬制工业明胶,制成药用胶囊,最终进入消费者腹中.工业明胶,是一种淡黄色或棕色的碎粒,无不适气味,无肉眼可见杂质.其分子量为1-10万,水分和无机盐含量在16%以下,蛋白质含量在82%以上,是一种理想的蛋白源.
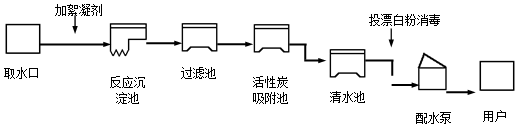
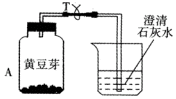 小明为了探究植物也能呼吸,做了以下实验:把装有吸干外表水的黄豆芽的塑料瓶A放在暗处24小时;导管T处用夹子夹住,不让外界空气进入;24小时后,观察塑料瓶壁;把T处夹子打开,用力压A瓶,让瓶内气体通入到右侧烧杯内,发现澄清石灰水变浑浊,塑料瓶内壁有水珠,用温度 计测量豆芽温度,可发现温度升高.
小明为了探究植物也能呼吸,做了以下实验:把装有吸干外表水的黄豆芽的塑料瓶A放在暗处24小时;导管T处用夹子夹住,不让外界空气进入;24小时后,观察塑料瓶壁;把T处夹子打开,用力压A瓶,让瓶内气体通入到右侧烧杯内,发现澄清石灰水变浑浊,塑料瓶内壁有水珠,用温度 计测量豆芽温度,可发现温度升高.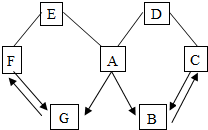 如图所示A~G是初中科学中常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A是人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物.请回答:
如图所示A~G是初中科学中常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A是人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物.请回答: