题目内容
17.某研究小组在学习氧气的化学性质时发现:大多数可燃物在空气中就能燃烧,而铁丝在空气中不能燃烧,在氧气中可以剧烈燃烧.该小组同学进行了下列探究.【提出猜想】由以上事实可以做出以下猜想:
猜想一:可燃物燃烧的剧烈程度可能与氧气的浓度有关.
猜想二:可燃物燃烧的剧烈程度与可燃物的种类有关.(请补充完整)
【提出问题】可燃物的燃烧与氧气的浓度的大小有什么关系?
【查阅资料】在规定的条件下,物质在氧气、氮气混合气流中,维持稳定燃烧所需的最低氧气浓度(以氧气所占的体积百分数表示)叫氧指数.氧指数高表示材料不易燃,氧指数低表示材料容易燃烧.一般认为:氧指数<27%属易燃材料,27%≤氧指数<32%属可燃材料,氧指数≥32%属难燃材料.下面是一些常见物质氧指数.
| 可燃物 | 红磷 | 木炭 | 硫 | 蜡烛 | 铁丝 |
| 氧指数 | 0.5% | 4% | 4.5% | 5%~6% | 60% |
(1)写出铁丝在氧气中燃烧的化学方程式3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
(2)由上表可知铁丝是难燃材料(填“易燃”“可燃”或“难燃”)
(3)在测定空气中氧气含量的实验中,我们通常选择红磷燃烧而不选择木炭或硫的原因是木炭或硫燃烧后的产物为气体.
【反思与评价】
(4)如果一定要用木炭代替红磷做这个实验,只要对实验稍作改进即可,需要对实验改进的是将蒸馏水改成氢氧化钠溶液;
理由是:氢氧化钠溶液对二氧化碳的吸收效果比蒸馏水好.
(5)即使这样的改进,根据上表数据可知:仍然没有用红磷燃烧好,原因是:木炭氧气含量在4%以下就不能燃烧了,而红磷仅仅到0.5%以下才不能燃烧,使得氧气反应更充分.
分析 【提出猜想】根据可燃物的种类不同燃烧的剧烈程度不同;
【设计并实验】
(1)根据铁丝在氧气中燃烧生成了四氧化三铁分析回答;
(2)根据铁的氧指数分析判断;
(3)根据木炭或硫燃烧后的产物分析回答;
【反思与评价】
(4)根据氢氧化钠能与与二氧化碳反应分析回答;
(5)根据木炭、红磷的氧指数分析回答.
解答 解:【提出猜想】由题干中的信息大多数可燃物在氧气中能燃烧,而铁丝不能燃烧,说明可燃物的种类不同发生燃烧的剧烈程度不同;故答为:【提出猜想】可燃物的种类;
【设计并实验】
(1)铁丝在氧气中剧烈燃烧,火星四射生成黑色固体四氧化三铁,反应的化学方程式为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;故填:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4
(2)根据表中的数据分析可以得出铁丝属于:难燃物,故填:难燃;
(3)测定空气中氧气含量用红磷是因为红磷燃烧生成固体五氧化二磷能引起装置内气体压强减小,而木炭或硫燃烧后的产物为气体不会引起装置内气体压强的变化,所以不能使用木炭或硫来代替红磷完成实验,故填:木炭或硫燃烧后的产生为气体;
【反思与评价】
(4)二氧化碳能被碱溶液吸收,如果要用木炭代替红磷来完成实验,可将蒸馏水改成氢氧化钠溶液;氢氧化钠溶液吸收二氧化碳的能力比蒸馏水要强,故填:将蒸馏水改成氢氧化钠溶液;氢氧化钠溶液对二氧化碳的吸收效果比蒸馏水好;
(5)根据表格中氧指数分析,红磷燃烧消耗氧气更彻底,木炭氧气含量在4%以下就不能燃烧了,而红磷仅仅到0.5%以下才不能燃烧,使得氧气反应更充分,故填:木炭氧气含量在4%以下就不能燃烧了,而红磷仅仅到0.5%以下才不能燃烧,使得氧气反应更充分.
点评 本题难度不大,考查氧气的化学性质、影响可燃物燃烧的剧烈程度的因素及同学们灵活运用所学知识解题的能力.

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | CH3COOH | B. | H2O和CO2 | C. | O2和H2O | D. | CO2 |
| A. | 它们是两种新型的化合物 | B. | 它们是由碳元素形成的两种单质 | ||
| C. | 它们的化学性质是完全相同的 | D. | 它们的相对分子质量相差为120 |
| A. | 硫酸铜溶液和氟化钡溶液 | B. | 氢氧化钙钡溶液和稀硝酸 | ||
| C. | 硫酸和硝酸钾溶液 | D. | 碳酸钾溶液和稀硝酸 |
| 实验编号 | 温度 | 催化剂 | 质量分数 | |
| 甲组实验Ⅰ | 25℃ | 二氧化锰 | 10mL 2%H2O2 | |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |

根据上述实验,请分析回答下列问题:
(1)根据甲小组的实验方案,甲小组是为了研究浓度对H2O2分解速率的影响;
(2)本实验是通过保持温度、催化剂不变,改变过氧化氢溶液的浓度来比较H2O2分解速率;
(3)根据实验数据分析,乙小组提出用BaO2固体与硫酸溶液反应制备H2O2,化学方程式:BaO2+H2SO4═BaSO4↓+H2O2,支持这一方案的理由是过氧化氢在酸性环境下分解较慢.
实验药品:稀硫酸、稀盐酸、氢氧化钠溶液、碳酸钠溶液、硝酸钡溶液、
氯化钠溶液、酚酞溶液
【提出问题】复分解反应发生的条件是什么?
【查阅资料】硝酸钡溶液显中性,且Ba2+有毒.
【实验探究】玲玲用上述物质做了下列几组实验.
| 组合序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 组合物质 | H2SO4 NaOH | H2SO4 NaCl | H2SO4 Na2CO3 | H2SO4 Ba(NO3)2 | NaOH Ba(NO3)2 | Na2CO3 Ba(NO3)2 |
(2)请写出组合④的化学方程式H2SO4+Ba(NO3)2=BaSO4↓+2HNO3.
【实验结论】他们请教老师并讨论后知道,只有当两种化合物互相交换成分,生成物中有沉淀或水或气体生成时,复分解反应才可以发生.
【应用】写出利用熟石灰鉴别化肥氯化铵和氯化钾有关反应的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
【拓展延伸】实验结束后,他们将所有废液收集在废液缸中静置,观察到白色沉淀和无色的上层清液.为了确定沉淀和清液的成分,继续展开探究.
【实验1】探究沉淀的成分.
【提出猜想】Ⅰ.沉淀只有硫酸钡Ⅱ.沉淀只有碳酸钡Ⅲ.沉淀中含有硫酸钡和碳酸钡.梅梅取少量沉淀于试管中,滴加过量的稀盐酸,观察到的现象是沉淀部分溶解,有气泡产生,证明了猜想Ⅲ是正确的.
【实验2】探究清液的成分.
①取少量清液于试管中,向其中滴加几滴硝酸钡溶液,无明显现象.
②另取少量清液于另一只试管中,滴加几滴稀硫酸,有白色沉淀产生.
【解释与结论】探究活动结束后,小组内成员通过讨论分析,一致认为清液中含有的离子除Na+、Cl-外,还有NO3-、Ba2+(指示剂除外).
【处理废液】为了防止污染环境,玲玲向废液缸中加入适量的碳酸钠溶液,对废液进行处理后,将固体回收进一步处理,溶液排放.
【交流与反思】根据你对物质溶解性的了解,结合复分解反应发生的条件,请写出一种在水溶液中一般不能发生复分解反应的可溶性盐NaNO3(写化学式).

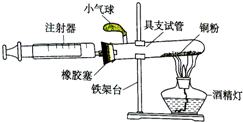 某化学兴趣小组在实验室利用自己设计的装置(如图)测定空气中氧气的含量.
某化学兴趣小组在实验室利用自己设计的装置(如图)测定空气中氧气的含量.