题目内容
7.据科技报报道,2016年01月30日,诺贝尔化学奖获得者乔治•欧拉团队,首次采用基于金属钉的催化剂,将从空气中捕获的二氧化碳与氢分子作用将其转化为甲醇(CH3OH),转化率高达79%.请根据报道,回答下列问题:(1)该反应的化学方程式如下所示,请在“空格”中填写适当的化学式,将其补充完整.
CO2+3H2$\frac{\underline{催化剂}}{△}$CH3OH+H2O
(2)二氧化碳与一氧化碳组成元素种类相同,但其化学性质差异很大.可以用澄清的石灰水(或灼热的氧化铜等)鉴别二氧化碳与一氧化碳.
(3)关于这一研究成果,下列分析中正确的是ABD.
A.消耗了二氧化碳,能减缓温室效应 B.甲醇是清洁能源,可替代化石燃料
C.金属钉是贵金属,反应成本比较高 D.反应转化率较高,有广阔发展前景.
分析 (1)根据质量守恒定律反应前后原子的种类及数目不变将方程式补充完整;
(2)根据二氧化碳和一氧化碳的性质分析回答;
(3)根据题干中的转化反应、温室效应、催化剂的特点等知识分析判断有关的说法.
解答 解:(1)在化学方程式为CO2+3H2═CH3OH+X”中,根据质量守恒定律的意义反应前后原子的种类及数目不变,则可知X中含有2个氢原子、一个氧原子,故可推测其中X的化学式为H2O.
(2)二氧化碳与一氧化碳组成元素种类相同,但其化学性质差异很大.由于二氧化碳能与氢氧化钙反应生成了碳酸钙沉淀和水,一氧化碳不与氢氧化钙反应,(或一氧化碳具有还原性,二氧化碳不具有还原性),所以可以用澄清的石灰水(或灼热的氧化铜等)鉴别二氧化碳与一氧化碳.
(3)A.该反应消耗了二氧化碳,能减缓温室效应,故A说法正确;
B.甲醇是清洁能源,可替代化石燃料,故B说法正确;
C.金属钉在该反应中是催化剂,化学性质和质量不变,故C说法错误;
D.由题意可知,反应转化率高达79%,有广阔发展前景,故D说法正确.
故答为:(1)H2O;(2)澄清的石灰水(或灼热的氧化铜等);(3)ABD.
点评 本题属于信息给予题,解题的关键是根据题干提取有用的信息结合已有的知识分析解答有关的问题.

练习册系列答案
相关题目
4.学习和研究化学,有许多重要方法.下列方法中所举示例错误的是( )
| 选项 | 方法 | 示例 |
| A | 实验法 | 用新配制的氢氧化铜悬浊液检验葡萄糖 |
| B | 归纳法 | 水、二氧化碳是分子构成的,归纳出所有物质都是由分子构成的 |
| C | 分类法 | 根据组成物质的元素种类,将纯净物分为单质和化合物 |
| D | 对比法 | 用等体积的水和空气进行压缩,得出气体与液体微粒间的空隙不同 |
| A. | A | B. | B | C. | C | D. | D |
5.某化学兴趣小组的同学们学习了纯碱的知识后,对著名的侯氏制碱法产生了浓厚的兴趣,决定对侯氏制碱法进行深入的探究,请你一起参与他们的探究.
【查阅资料】
Ⅰ.侯氏制碱法的原理:
第一步:向饱和食盐水中先通入过量氨气(溶液显碱性),再通入过量的二氧化碳,即可析出NaHCO3固体,反应方程式是:NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl.
第二步:将第一步反应后所得的混合物进行过滤后,将滤渣加热,可生成纯碱、一种能使澄清石灰水变浑浊的气体和一种常见的氧化物.
Ⅱ.已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解得气体体积)
Ⅲ.已知NH4Cl加热条件下易分解,反应的化学方程式是NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑
【资料回顾】
(1)第一步中析出NaHCO3固体的原因是相同条件下,碳酸氢钠的溶解度比氯化钠和碳酸钠小,实验中先向饱和食盐水中通入过量氨气,再通入过量的二氧化碳,其原因是①(填序号).
①使CO2更易被吸收 ②NH3比CO2更易制取 ③CO2的密度比NH3大
(2)写出第二步中将滤渣加热发生反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(3)该工业同时可得副产物NH4Cl,它在农业上可作氮肥,写出NH4Cl与熟石灰固体加热的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
【定性探究】
第一步反应所得混合物在第二步过滤后所得滤液中溶质的成分是什么?
【作出猜想】
猜想Ⅰ:NH4Cl
猜想Ⅱ:NH4Cl和NaHCO3
猜想Ⅲ:NH4Cl和NaCl
猜想Ⅳ:NH4Cl、NaCl和NaHCO3.
【设计实验】
【交流讨论】小明同学认为步骤②结论不正确,他的理由是氯化铵能和硝酸银反应生成白色沉淀氯化银.
小张为证明滤液中是否含NaCl,设计了以下方案:另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,往其中滴加足量稀HNO3后,再滴加AgNO3溶液,产生白色沉淀.
【得出结论】猜想Ⅳ成立.
【定量探究】
实际生产中得到的纯碱样品中含有少量NaCl,国际上规定纯碱的纯度(即纯碱的质量分数)≥98.0%为合格品,同学们想判断某纯碱样品是否合格,分成四个小组,各取25克该样品全部溶解于水中,向其中加入相同溶质质量分数的CaCl2溶液.四组加入的CaCl2溶液的质量与产生的沉淀的质量关系如表.
(1)通过计算判断该纯碱样品是否是合格品?
(2)若要计算CaCl2溶液的溶质质量分数,可以选择第一、二组数据计算.
【查阅资料】
Ⅰ.侯氏制碱法的原理:
第一步:向饱和食盐水中先通入过量氨气(溶液显碱性),再通入过量的二氧化碳,即可析出NaHCO3固体,反应方程式是:NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl.
第二步:将第一步反应后所得的混合物进行过滤后,将滤渣加热,可生成纯碱、一种能使澄清石灰水变浑浊的气体和一种常见的氧化物.
Ⅱ.已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解得气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
【资料回顾】
(1)第一步中析出NaHCO3固体的原因是相同条件下,碳酸氢钠的溶解度比氯化钠和碳酸钠小,实验中先向饱和食盐水中通入过量氨气,再通入过量的二氧化碳,其原因是①(填序号).
①使CO2更易被吸收 ②NH3比CO2更易制取 ③CO2的密度比NH3大
(2)写出第二步中将滤渣加热发生反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(3)该工业同时可得副产物NH4Cl,它在农业上可作氮肥,写出NH4Cl与熟石灰固体加热的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
【定性探究】
第一步反应所得混合物在第二步过滤后所得滤液中溶质的成分是什么?
【作出猜想】
猜想Ⅰ:NH4Cl
猜想Ⅱ:NH4Cl和NaHCO3
猜想Ⅲ:NH4Cl和NaCl
猜想Ⅳ:NH4Cl、NaCl和NaHCO3.
【设计实验】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量滤液于试管中,滴加稀盐酸 | 产生无色无味气体 | 证明滤液中含有的物质是NaHCO3 |
| ②另取少量滤液于试管中,滴加足量稀HNO3后,再滴加AgNO3溶液 | 产生白色沉淀 | 证明滤液中含有NaCl |
小张为证明滤液中是否含NaCl,设计了以下方案:另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,往其中滴加足量稀HNO3后,再滴加AgNO3溶液,产生白色沉淀.
【得出结论】猜想Ⅳ成立.
【定量探究】
实际生产中得到的纯碱样品中含有少量NaCl,国际上规定纯碱的纯度(即纯碱的质量分数)≥98.0%为合格品,同学们想判断某纯碱样品是否合格,分成四个小组,各取25克该样品全部溶解于水中,向其中加入相同溶质质量分数的CaCl2溶液.四组加入的CaCl2溶液的质量与产生的沉淀的质量关系如表.
| 第一组 | 第二组 | 第三组 | 第四组 | |
| CaCl2溶液的质量(克) | 100 | 200 | 300 | 400 |
| 产生沉淀的质量(克) | 8 | 16 | 20 | 20 |
(2)若要计算CaCl2溶液的溶质质量分数,可以选择第一、二组数据计算.
2.除去下列物质中的杂质,所选用的试剂和操作方法都正确的是( )
| 选项 | 物质 | 杂质(少量) | 试剂及操作方法 |
| A | 氧化钙 | 石灰石 | 高温 |
| B | 氢氧化钠溶液 | 碳酸钠 | 加入过量的氢氧化钙溶液,过滤 |
| C | 氯化亚铁 | 锌 | 加入足量的水,溶解、过滤 |
| D | 氯化钠固体 | 泥沙 | 加适量的水溶解、过滤、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
17.如图图象不能正确反映其对应的实验操作的是( )
| A. | 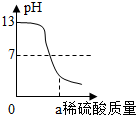 将锌片插入盛有一定量稀硫酸的烧杯中 将锌片插入盛有一定量稀硫酸的烧杯中 | |
| B. | 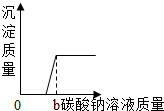 向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量 向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量 | |
| C. | 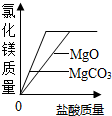 向足量碳酸镁和氧化镁固体中分别加入相同质量、相同质量分数稀盐酸中 向足量碳酸镁和氧化镁固体中分别加入相同质量、相同质量分数稀盐酸中 | |
| D. | 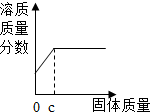 向盛有一定量稀盐酸的烧杯中不断滴入NaOH溶液至过量 向盛有一定量稀盐酸的烧杯中不断滴入NaOH溶液至过量 |

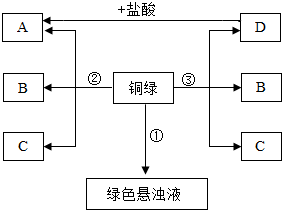 小彤的一副眼镜戴了一段时间后,发现铜质镜架上出现了一墨绿色物质,他想将其除掉.经查阅资料得知:铜在一定条件下会锈蚀生成一种绿色物质,其主要成分是碱式碳酸铜(俗称铜绿)[Cu2(OH)2CO3],于是他和几个同学按如下方案进行了实验.
小彤的一副眼镜戴了一段时间后,发现铜质镜架上出现了一墨绿色物质,他想将其除掉.经查阅资料得知:铜在一定条件下会锈蚀生成一种绿色物质,其主要成分是碱式碳酸铜(俗称铜绿)[Cu2(OH)2CO3],于是他和几个同学按如下方案进行了实验.